Фосфористый ангидрид
Cтраница 1
Фосфористый ангидрид получается, если фосфор сгорает при недостаточном доступе кислорода. [1]
Фосфористый ангидрид и фосфористая кислота проявляют восстановительные свойства. [2]
Фосфористый ангидрид получается при медленном окислении фосфора или при сгорании его в условиях недостатка воздуха. Фосфорный ангидрид образуется при горении фосфора на воздухе или в кислороде. Это белое вещество, легко присоединяющее воду; применяется в лабораторной практике как осушающее средство. [3]
Фосфористый ангидрид и фосфористая кислота проявляют восстановительные свойства. [4]
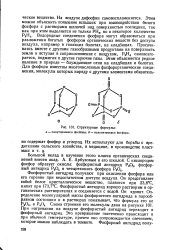 |
Структурные формулы. а - полутораокиси фосфора. б - полупятиокиси фосфора. [5] |
Фосфористый ангидрид получают при окислении фосфора или его горении при недостаточном доступе воздуха. Он представляет собой белое кристаллическое вещество, плавится при 23 8еС, кипит при 173 7 С. Фосфористый ангидрид хорошо растворим в органических растворителях и соединяется с водой. При нагревании на воздухе фосфористый ангидрид переходит в фосфорный ангидрид. Это превращение постепенно происходит и при обычной температуре, причем оно сопровождается свечением, которое можно наблюдать в темноте. [6]
Фосфористый ангидрид ( Р2О3) образуется в результате горения фосфора при недостатке воздуха или при медленном окислении фосфора при обычных температурах. Это белая, похожая на воск, кристаллическая масса. [7]
Фосфористый ангидрид Р203 - белая кристаллическая масса, плавящаяся при 23 8 С. [8]
 |
Камера для обработки проб фосфорного ангидрида. [9] |
Фосфорный и фосфористый ангидрид определяют в пробе известными методами. Здесь мы обратим внимание лишь на приготовление испытуемого раствора для анализа на Р205 и Р203 и на определение плотности полученного продукта. [10]
Как получают фосфористый ангидрид. Существует ли разница в продуктах взаимодействия фосфористого ангидрида с холодной или горячей водой. [11]
Растворить полученный ранее фосфористый ангидрид в небольшом количестве воды. [12]
Определения молекулярного веса фосфористого ангидрида и в газообразном состоянии и в растворах согласно приводят к удвоенной формуле ( Р4Об), которой отвечает приводимая на рис. IX-29 пространственная структура. Энергия связи Р - О оценивается в 80 ккал / моль. [13]
Определения молекулярного веса фосфористого ангидрида и в газообразном состоянии и в растворах согласно приводят к удвоенной формуле ( Р4Ое), которой отвечает приводимая на рис. IX-29 пространственная структура. Энергия связи Р - О оценивается в 80 ккал / моль. [14]
Полученное вещество называется фосфористым ангидридом. [15]
Страницы: 1 2 3 4