Избыток - связывающий электрон
Cтраница 1
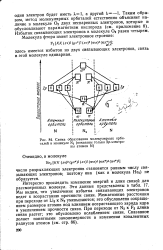 |
Схема образования молекулярных орби. [1] |
Избыток связывающих электронов в молекуле О2 равен четырем. [2]
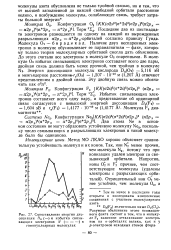 |
Сопоставление энергии диссоциации. 00 ( - и избытка связывающих электронов N ( - - - - - - - - - - - в. [3] |
Избыток связывающих электронов составляет всего одну пару, и представление об ординарной связи согласуется с невысокой энергией диссоциации D0 ( p2) 1 604 эВ и re ( F2) 1 4177 Ю 10 м ( 1 4177 А. [4]
Здесь избыток связывающих электронов упал до одной пары, ординарная о-связь характеризуется еще более низкой энергией диссоциации и возросшим межъядерным расстоянием 7 ( ( О22 -) 1 49 А. [5]
У N2 избыток связывающих электронов равен 6, 3 валентные химические связи. У О2 избыток связывающих электронов 4, ковалентность 2, 2 неспаренных электрона на разрыхляющих л - и л - орбиталях, кислород парамагнитен. Магнитные свойства ( см. 9.3) кислорода, следовательно, получают достоверное объяснение в методе МО. [6]
Мы видим, что увеличение избытка связывающих электронов ведет к возрастанию прочности связи. Межатомные расстояния от Li2 к N2 уменьшаются; это обусловлено сокращением размеров атомов под влиянием возрастающего заряда ядра и увеличением прочности связи. При переходе от N2 к F2 длина связи растет; это обусловлено ослаблением связи. Сказанное делает понятными закономерности в изменении ковалентных радиусов атомов ( см. стр. [7]
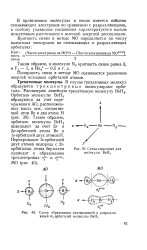 |
Схема координат для молекулы ВеН2.| Схема образования связывающей и разрыхляющей ст - орбиталей молекулы ВеН2. [8] |
В приведенных молекулах и ионах имеется избыток связывающих электронов по сравнению с разрыхляющими, и поэтому указанные соединения характеризуются малым межатомным расстоянием и высокой энергией диссоциации. [9]
Как следует из приведенных данных, увеличение избытка связывающих электронов ведет к возрастанию прочности связи. Меж-гтомные расстояния уменьшаются от Li2 к N2, это обусловлено влиянием возрастающего заряда ядра и увеличением прочности связи. При переходе от N2 к F2 длина связи растет, это обусловлено ослаблением связи. Сказанное делает понятными закономерности в изменении ковалентных радиусов атомов ( см. разд. [10]
Как следует из приведенных данных, увеличение избытка связывающих электронов ведет к возрастанию прочности связи. Межатомные расстояния уменьшаются от U2 к N2, что обусловлено ростом заряда ядра и увеличением прочности связи. При переходе от N2 к F2 длина связи растет, что обусловлено ослаблением связи. Отсюда становятся понятными закономерности в изменении ковалентных радиусов атомов ( см. разд. [11]
Как следует из приведенных данных, увеличение избытка связывающих электронов ведет к возрастанию прочности связи. Межатомные расстояния уменьшаются от U2 к N2, что обусловлено ростом заряда ядра и увеличением прочности связи. При переходе от NJ к FJ длина связи растет, что обусловлено ослаблением связи. Отсюда становятся понятными закономерности в изменении ковалентных радиусов атомов ( см. разд. [12]
Как следует из приведенных данных, увеличение избытка связывающих электронов ведет к возрастанию прочности связи. Межатомные расстояния уменьшаются от 1Л2 к N2, это обусловлено влиянием возрастающего заряда ядра и увеличением прочности связи. При переходе от N2 к F2 длина связи растет, это обусловлено ослаблением связи. Сказанное делает понятными закономерности в изменении ковалентных радиусов атомов ( см. разд. [13]
В молекуле С2 разрыхляющих электронов два, а связывающих - шесть, избыток связывающих электронов равен четырем, поэтому можно считать, что связь в данной молекуле двойная. [14]
В молекуле С2 разрыхляющих электронов два, а связывающих - шесть, избыток связывающих электронов равен четырем, поэтому можно считать, что связь в данной молекуле двойная. [15]
Страницы: 1 2 3 4