Способность - электрон
Cтраница 4
 |
Некоторые свойства атомов германия, олова и свинца. [46] |
Поэтому, если между атомами углерода устанавливаются прочные козалент-ные связи, то уже между атомами кремния эти связи менее прочны. За счет энергии теплового движения эти связи нарушаются, наружные электроны освобождаются и начинают перемещаться по веществу. При определенных условиях у германия возникает электронная проводимость и он становится полупроводником. У олова и свинца способность электронов отрываться от их атомов еще более возрастает, а поэтому у этих элементов усиливаются металлические свойства. [47]
 |
Некоторые свойства атомов германия, олова и свинца. [48] |
Поэтому, если между атомами углерода устанавливаются прочные ковалентные связи, то уже между атомами кремния эти связи менее прочны. За счет энергии теплового движения эти связи нарушаются, наружные электроны освобождаются и начинают перемещаться по веществу. При определенных условиях у германия возникает электронная проводимость и он становится полупроводником. У олова и свинца способность электронов отрываться от их атомов еще более возрастает, а поэтому у этих элементов усиливаются металлические свойства. [49]
 |
Некоторые свойства атомов германия, олова и свинца. [50] |
С-РЬ с-увеличением размеров атомов уменьшается 1ритяжение к ядру наруж. За счет энергии теплового движения эти связи нарушаются, наружные электроны осво - Зождаются и начинают перемещаться по веществу. При определенных условиях у германия возникает электрон - 1ая проводимость и он становится полупроводником. У олова и свинца способность электронов отрываться т их атомов еще более возрастает, а поэтому у этих элементов усиливаются металлические свойства. [51]
Металлический америций с плотностью 11 7 г / см3 получается в результате восстановления AmFs барием при температуре 1000 - 1200 С. Он слегка тускнеет в сухом воздухе и растворяется в кислотах с выделением водорода. С водородом он взаимодействует при 50 С, образуя порошкообразный черный гидрид. Низкая плотность металла, по сравнению с плотностью урана и плутония, вероятно, отражает уменьшение способности электронов 5 / - оболочки принимать участие во внутриатомных взаимодействиях. [52]
Нетрудно убедиться, что у устойчивой формы нормальной водородной молекулы результирующий электронный спин равен нулю. Следовательно, возникновение устойчивой молекулы может происходить только при образовании пары из двух электронов с противоположными спинами. Этот вывод навел Лондона [13] на мысль, что в общем случае образование валентной связи обусловлено способностью электрона одного атома образовывать пару с противоположным по спину электроном другого атома. [53]
Электроны в атоме имеют определенные дискретные значения энергии - уровни, как принято говорить. При сближении атомов друг с другом у электронов появляется возможность обмениваться местами. Надо вспомнить, что микрочастицы могут проходить через потенциальные барьеры - области пространства, где потенциальная энергия больше полной энергии частицы. В результате таких переходов одинаковые уровни энергии расщепляются, причем разность соседних уровней энергии определяется энергией взаимодействия атомов друг с другом - способностью электронов перебираться из одного атома в другой. Электроны, если их всего два, как в двух атомах водорода, оккупируют нижний уровень; их спины при этом, естественно, будут антипараллельны. [54]
Предел применимости метода прохождения налагается неспособностью электронов проходить через толстые пленки. Но в применении к изучению массивных слоев теряется и ценность электронографического метода, так как именно в возможности познания тонких пленок и заключается преимущество метода диффракции электронов. С другой стороны, метод диффракции электронов неприменим для исследования слишком тонких пленок. Однако этот предел очень низок; при наличии трех-четырех атомных плоскостей диффракция оказывается возможной и наблюдаемой. Это обусловлено способностью электронов рассеиваться в миллионы раз сильнее рентгеновских лучей. [55]
 |
Некоторые свойства атомов германия, олова и свинца. [56] |
В ряду С - РЬ с увеличением размеров атомов уменьшается притяжение к ядру наружных электронов. Поэтому, если между атомами углерода устанавливаются прочные ковалент-ные связи, то уже между атомами кремния эти связи менее прочны. За счет энергии теплового движения эти связи нарушаются, наружные электроны освобождаются и начинают перемещаться по веществу. При определенных условиях у германия возникает электронная проводимость и он становится полупроводником. У олова и свинца способность электронов отрываться от их атомов еще более возрастает, а поэтому у этих элементов усиливаются металлические свойства. [57]
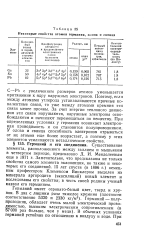 |
Некоторые свойства атомов германия, олова и свинца. [58] |
С-РЬ с увеличением размеров атомов уменьшается притяжение к ядру наружных электронов. Поэтому, если между атомами углерода устанавливаются прочные ко-валентные связи, то уже между атомами кремния эти связи менее прочны. За счет энергии теплового движения эти связи нарушаются, наружные электроны освобождаются и начинают перемещаться по веществу. При определенных условиях у германия возникает электронная проводимость и он становится полупроводником. У олова и свинца способность электронов отрываться от их атомов еще более возрастает, а поэтому у этих элементов усиливаются металлические свойства. [59]
Страницы: 1 2 3 4