Сравнение - длина - связь
Cтраница 1
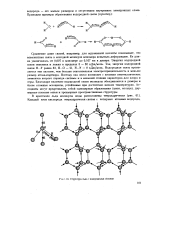 |
Структура льда с водородными связями. [1] |
Сравнение длин связей, например, для муравьиной кислоты показывает, что ковалентная связь в исходной молекуле мономера испытала деформацию. [2]
Сравнение длин связей, например для муравьиной кислоты, показывает, что ковалентная связь в исходной молекуле мономера испытала деформацию. [3]
Данные спектров ИК [ За ], ЯМР [51, 58] и рентгеноструктурного анализа свидетельствуют о равноценности углеродных атомов в пятичленном кольце. Сравнение длин связей и углов группы Мп ( СО) 3 в ЦТМ [50] с соответствующими параметрами Мп2 ( СО) 10 [72] показало очень небольшое различие. [4]
Любое укорачивание этой связи должно быть приписано сжатию, вызываемому делокализацией электронов, способных перемещаться по всей системе ( см. стр. Все это необходимо учитывать при сравнении длин связей, полученных экспериментальным путем и на основе вышеуказанного уравнения. Тем не менее, сравнение обоих результатов чрезвычайно интересно. [5]
Этот факт используется как доказательство более сильных электроноакцепторных свойств фураза-нового кольца по сравнению с нитрогруппой. Однако аргументы, основанные на относительной длине связей в комплексе, без сравнения длин связей в исходном фуразане и эффектов напряжения в этой системе с конденсированными ядрами мало убедительны. [6]
Следует отметить, что этот метод определения длины связи из значений расстояний между пиками Р - R менее прямой, чем метод, используемый для любой разрешенной вращательной структуры или для дифракционных исследований, и не только гораздо менее точен, но и может быть источником ошибочного толкования результатов. Однако этот метод был применен для предварительной оценки длины связи, а также для сравнения длин связей в парах и в твердом состоянии. [7]
Значение вращательной постоянной молекулы PbF, приведенное в табл. 289, было вычислено для гРЬР 2 05 А. Это значение межатомного расстояния в молекуле PbF было принято на основании длины связи РЬ-F вмолекуле PbF2, равной, согласно [70], 2 13А и сравнения длин связей М - X в молекулах MX, MX - j и МХ4, где М - атом элемента IV группы, а X - атом галогена. Вероятная погрешность принятого значения ГРЬР равна 0 07 А. [8]
 |
Обычные ковалентные радиусы и электроотрицательности. [9] |
Из этого следует, что само введение электроотрицательности является следствием допущения аддитивности радиусов. Здесь не предполагается обсуждать способы вычисления электроотрицательности, для которых нет прочных теоретических основании, но поскольку благодаря Шомакеру и Стевен-сону ( Schomaker, Stevenson) при сравнении длин связей с суммами ковалентных радиусов широко используется уравнение, в которое входят электроотрицательности, в табл. 7.4 приведены как электроотрицательности, так и ковалентные радиусы некоторых элементов. [10]
Для неорганических соединений при откладывании зависимости длины связи от ее энергии не получается однозначного соотношения. Как видно из рис. 3, отклонение от линейности может быть связано с ионным характером молекул. При сравнении длин связи соединений с приблизительно равными энергиями диссоциации с длинами связи ковалентных молекул с такими же энергиями диссоциации можно заключить, что различие увеличивается с ростом степени ценности связи. [11]
Результаты первых работ по исследованию карбонилгидридов переходных металлов методами спектроскопии и дифракции электронов позволили сделать следующие выводы: 1) - атом водорода не влияет на стереохимию этих соединений, 2) атом водорода погружен в орбитали металла. С появлением рентгеноструктурных данных стало очевидно, что в действительности атом водорода проявляет стереохимическое влияние. Оказалось, что связь металл - водород имеет длину порядка 1 7 А, характерную для нормальной ковалентной связи. Геометрия молекул гидридных комплексов в большей мере зависит от числа и размера лигандов; степень отклонения от идеальной геометрии увеличивается при возрастании объема лигандов и кратности связи в транс-положении к координированному гидрид-иону. Значительное трансвлияние координированного гидрид-иона очевидно из сравнения длин связей в этих комплексах. Методом дифракции рентгеновских лучей и ( или) нейтронов изучены структуры примерно шестидесяти гидридных комплексов переходных металлов. Среди комплексов, содержащих мостиковый водород, встречаются структуры, в которых атом водорода связывает два и больше атомов переходных металлов, или переходный металл и бор, или переходный металл и кремнии. [12]
Рассмотрим металл литий с кристаллической структурой о. В атоме лития имеются только три электрона, основное состояние которых ( ls) 2 ( 2s); радиус иона Li ( ls) 2 ( табл. 28 на стр. На внутренние сильно связанные электроны другие атомы лития почти не будут оказывать влияния, поэтому мы приходим к выводу, что один и только один валентный электрон каждого атома сообщает кристаллу металлические свойства. Все связи атома с его ближайшими четырнадцатью соседями обязаны своим существованием этому единственному ( на каждый атом) электрону, связывающая сила которого, таким образом, размазана. Это следует также из сравнения длины связи. [13]
Страницы: 1