Сравнение - адсорбция
Cтраница 1
Сравнение адсорбции на этих адсорбентах показывает, что скорость насыщения порошкообразного цеолита значительно больше, чем гранулированного. Причина такого различия не только в том, что частицы адсорбата должны пройти вторичные поры гранулы адсорбента. Наиболее вероятной причиной кажется закрытие части поверхности кристаллов цеолита связующим веществом. Волощук и Золотарев считают, что причина уменьшения скорости адсорбции в гранулах по сравнению с кристаллическим порошком цеолита заключается в изменении свойств кристаллов цеолита в гранулах молекулярного сита во время их термической обработки в присутствии водяного пара. По нашему мнению, эта гипотеза дискуссионная. [1]
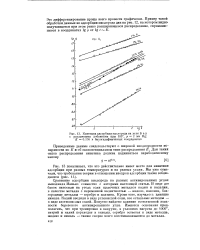 |
Кинетика адсорбции кислорода на угле Б а у. [2] |
Сравнение адсорбции кислорода на разных активированных углях выполняла Манько совместно с авторами настоящей статьи. В виде добавок наносили на уголь соли щелочных металлов калия и кальция, в качестве металла с переменной валентностью - железо, наконец, благородные металлы - серебро и платина. [3]
Для сравнения адсорбции на пористом и непористом адсорбенте были использованы образцы КСК-2 и БС-1, обладающие, как это видно из табл. 1, близкими значениями степени гидратации. Как следует из рис. А, полученные из обоих образцов данные качественно не отличаются друг от друга. Сравнение этих изотерм с изотермами, приведенными на рис. 1, показывает, что замена растворителя не оказывает существенного влияния на величину адсорбции изученных спиртов. При экстраполяции ее наклонной части до пересечения с осью абсцисс получалось значение, близкое к концентрации чистого спирта. Поскольку такая экстраполяция не может дать достаточно точных результатов, был проведен ряд дополнительных опытов по определению адсорбции ССЦ из его растворов в октиловом спирте. В интересующей нас области концентраций в пределах ошибок измерений заметной адсорбции не было обнаружено. [4]
Для сравнения адсорбции на пористом и непористом адсорбенте были использованы образцы КСК-2 и БС-1, обладающие, как это видно из табл. 1, близкими значениями степени гидратации. Как следует из рис. 1А, полученные из обоих образцов данные качественно не отличаются друг от друга. При экстраполяции ее наклонной части до пересечения с осью абсцисс получалось значение, близкое к концентрации чистого спирта. Поскольку такая экстраполяция не может дать достаточно точных результатов, был проведен ряд дополнительных опытов по определению адсорбции ССЦ из его растворов в октиловом спирте. В интересующей нас области концентраций в пределах ошибок измерений заметной адсорбции не было обнаружено. [5]
Проводилось сравнение адсорбции нормальных жирных кислот из бензола и гексана. Бензол взаимодействует с группами SiOH посредством л-связей, тогда как гексан такими связями не обладает. Причиной низкой степени покрытия в бензоле-является то, что в нем молекулы кислот С6 16 подвержены димеризации за счет образования водородных связей, причем димеры находятся в равновесии с мономерными молекулами кислот, концентрация которых в этом растворителе низка, а адсорбируются только лишь мономерные молекулы. [6]
Методом сравнения адсорбции паров воды и бензола установлен и объяснен факт гидрофобизации поверхности любых силикагелей, осуществляемой с помощью термообработки. [7]
При сравнении адсорбции различных ионов Фаянс и Эрдей-Грюц [13] установили следующие факторы, определяющие адсорбционную способность ионов. [8]
Так, при сравнении адсорбции н-бутана и изобутана сделан вывод, что ряд углей имеет поры диаметром 4 9 - 5 6 А при О С и около 4 А при 145 С. Однако адсорбционная емкость этих углей низка, а скорость адсорбции очень мала. [9]
Каррутерс и др. [20] провели сравнение адсорбции азота на четырех типах кремнеземных порошков; графическая зависимость v / vm как функция от vs ( где vm - значение емкости монослоя, определяемое из уравнения БЭТ) является прямо пропорциональной. [10]
Распространенность таких случаев должна расти при переходе от сравнения адсорбции сходных газов к адсорбпии газов, вызванной силами различной природы. Это связано с особенностями топографии активных участков. Действительно, для дисперсионной адсорбции участки с максимальными теплотами сорбции расположены в глубине узких пор и щелей, а участки с минимальными теилотами - на вершинах и ребрах кристалликов. В случае же электростатической сорбции на ионной решетке потенциал минимален в щелях, имеет среднее значение у ионов, расположенных на середине грани, и максимален у ребер и вершин. [11]
Влияние степени гидролиза соли ионита на обмен наглядно видно из сравнения адсорбции кремневой и борной кислот на слабо - и сильноосновных анионитах. [12]
При сравнении сорбтивов, близких по химическому характеру, как, например, при сравнении адсорбции разных галогенов или разных олефинов, можно ожидать симбатности в изменениях теплоты сорбции при переходе от одних участков к другим. Характер связи между - Qt и Q j при этом может быть различен. [13]
При замещении около 70 % Са 2 на Na для обоих цеолитов наблюдается своеобразное обращение молекулярно-ситового эффекта при сравнении адсорбции N2, с одной стороны, и С2НБОН и СдН7ОН - с другой. В то же время условия диффузии молекул этилового и пропилового спиртов в полости цеолитов существенно облегчаются, что видно из сопоставления кинетических кривых. При этом для этанола равновесие устанавливается достаточно быстро, поэтому могут быть получены равновесные изотермы адсорбции. [14]
Пограничное натяжение в максимуме электрокапиллярной кривой в отсутствие значительной специфической адсорбции ионов ( 0 1 М растворы KPF6) составляет 370 2 ( 25 С) и 373 5 ( 30 С) эрг / см2 для диметилсульфоксида и сульфолана соответственно, позволяя предположить, что диметилсульфоксид адсорбируется несколько прочнее. Однако, судя по значению работы адгезии ( табл. 1), справедливо обратное. Таким образом, следует ожидать также специфическую адсорбцию диметилсульфоксида и сульфолана на ртути. Для сульфолана это было подтверждено сравнением адсорбции из водных растворов на границах раздела фаз ртуть - раствор и воздух - раствор. [15]
Страницы: 1 2