Структура - большинство - металл
Cтраница 1
Структуры большинства металлов обладают плотной или близкой к плотной упаковкой. [1]
 |
Атомные радиусы металлов. [2] |
В настоящее время структура большинства металлов хорошо известна. Атомный радиус металла считают равным половине расстояния между центрами любых двух смежных атомов в решетке металла. Значения атомных радиусов металлов приведены в табл. 1.3. В пределах периода элементов атомные радиусы металлов уменьшаются, так как при одинаковом числе электронных слоев в атомах металлов возрастает заряд ядра, а следовательно, и притяжение ядром электронов. Так, для элементов третьего периода Na, Mg и Al радиусы г соответственно равны 189, 160, 143 пм. В меньшей степени снижается га элементов вставных декад, особенно в триадах элементов, входящих в VIII группу. [3]
 |
Атомные радиусы металлов. [4] |
В настоящее время структура большинства металлов хорошо известна. Атомный радиус металла считают равным половине расстояния между центрами любых двух смежных атомов в решетке металла. Значения атомных радиусов металлов приведены в табл. 1.3. В пределах периода элементов атомные радиусы металлов уменьшаются, так как при одинаковом числе электронных слоев в атомах металлов возрастает заряд ядра, а следовательно, и притяжение ядром электронов. Так, для элементов третьего периода Na, Mg и Al радиусы г. соответственно равны 189, 160, 143 пм. В меньшей степени снижается г элементов вставных декад, особенно в триадах элементов, входящих в V11I группу. [5]
 |
Атомные радиусы металлов. [6] |
В настоящее время структуры большинства металлов хорошо известны. [7]
В настоящее время структуры большинства металлов хорошо известны. Атомные радиусы металлов в периодах уменьшаются, так как в них при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, и притяжение им электронов; так, ( гат) № 1 89; ( raT) Mg 1 60; ( ГЯТ) А 1 43 А. Сравнительно медленно уменьшается гат элементов вставных декад, особенно в триадах элементов, входящих в VIII группу; так, если ( / - ат) зс Ц64 А и ( / - ат) т1 1 46 А, то гат для Ре Со и № равны соответственно 1 26; 1 25 и 1 24 А. Еще медленнее происходит уменьшение гат в подгруппе лантаноидов ( и актиноидов); так, при переходе от Се ( 1 83 А) до Lu ( 1 74 А) гат падает всего на 0 09 А. [8]
 |
Атомные радиусы металлов. [9] |
В настоящее время структуры большинства металлов хорошо известны. Разделив пополам расстояние между центрами любых двух смежных атомов в решетке металла, получаем атомный радиус. Значения атомных радиусов металлов приведены в табл. 1.3. Атомные радиусы металлов в периодах уменьшаются, так как при одинаковом числе электронных, слоев в атомах металлов возрастает заряд ядра, а следовательно, и притяжение ядром электронов. Так, для элементов третьего периода Na, Mg и Al ra соответственно равны 189, 160, 143 пм. Сравнительно медленно уменьшается га элементов вставных декад, особенно в триадах элементов, входящих в VIII группу. [10]
В настоящее время структуры большинства металлов хорошо известны. Сравнительно медленно уменьшается Гат элементов вставных декад, особенно в триадах элементов, входящих в VIII группу; так, если ( raT) scl 64A и ( гат) т1 1.46 А, то гат для Fe, Co и Ni равны соответственно 1 26; 1 25 и 1.24 А. Еще 1медленнее происходит уменьшение гат в подгруппе лантаноидов ( и актиноидов); так, при переходе от Се ( 1 83А) до Lu ( l 74A) гат падает всего на 0.09 А. [11]
Некоторые металлы в конце подгрупп В ( например, олово и висмут) имеют структуры более рыхлые и с меньшими координационными числами, чем типичные плотно-упакованные структуры большинства металлов. При этом делокализация электронов менее полная ( так, например, электропроводности этих металлов сравнительно малы) и связи можно рассматривать как промежуточные между металлическими и ковалентными. [12]
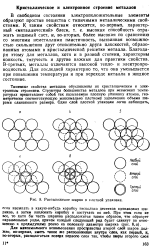 |
Расположение шаров в ллотной упаковке. [13] |
Типичные свойства металлов обусловлены нх кристаллическим и электронным строением. Структура большинства металлов при невысоких температурах представляет собой так называемую плотную упаковку атомов, геометрически соответствующую максимально плотному заполнению объема шарами одинакового размера. [14]
 |
Схема структуры кубической решетки.| Гексагональная решетка. [15] |
Страницы: 1 2