Структура - благородный газ
Cтраница 1
Структуры благородных газов, как выше было указано, можно рассматривать как молекулярные, с одноатомными молекулами, формально подчиняющиеся правилу К 8 - N, и с этой точки зрения они обоз-начаются так же, как структуры галогенов. [1]
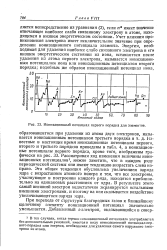 |
Ионизационный потенциал первого порядка для элементов. [2] |
При переходе от структуры благородных газов к ближайшему щелочному элементу ионизационный потенциал значительно уменьшается. [3]
Второй способ решения исходит из структур благородных газов. [4]
Чтобы проверить, обладает ли атом структурой благородного газа, необходимо иметь правило, позволяющее отнести электроны в молекуле к определенным атомам. [5]
Таким образом, все галоиды могут принимать структуру благородного газа ( соответственно Ne, А, 1 т, Хе) путем: а) образования иона X или б) образования одной ковалентной связи. Третьей простой возможностью является образование положительного иона типа [ R - X - R ], однако только иод ведет себя таким образом. Галоиды в парообразном, жидком или твердом состоянии образуют только двухатомные молекулы X - X, в которых каждый атом имеет одну ковалентную связь. В кристаллах хлора, брома и иода эти двухатомные молекулы удерживают друг друга ван-дер-ваальсовскими силами. [6]
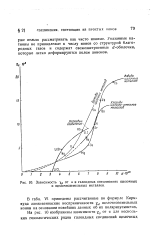 |
Зависимость ХР от а в галоидных соединениях щелочных и щелочноземельных металлов. [7] |
Указанные катионы не принадлежат к числу ионов со структурой благородных газов и содержат свежезастроенные d - оболочки, которые легко деформируются полем анионов. [8]
Галоиды, присоединяя электрон, образуют ионы со структурой благородного газа. Эта структура очень устойчива, и сродство к электрону у галоидов соответственно велико. [9]
В этой молекуле каждый атом приобретает аргоноидную структуру ( структуру благородного газа); поделенные электронные пары находятся в совместном владении и должны считаться принадлежащими каждому атому. Атом углерода с четырьмя поделенными парами электронов в L-юболочке и одной неподеленной парой в / sT - оболочке приобретает структуру неона, а каждый атом водорода - структуру гелия. [10]
Рассмотрим простейший случай молекулы, в которой изучаемый атом или ион имеет структуру благородного газа и не относится к переходным элементам с дефектами в строении электронных оболочек. В этом случае система, образующаяся в процессе рентгеновского поглощения, состоящая из вырванного из К-оболочки электрона и взаимодействующего с ним ядра атома, окруженного устойчивой электронной оболочкой, может приближенно рассматриваться как водородоподобный атом и относительно просто поддается расчету. Для проверки выводов теории можно воспользоваться экспериментальными данными, относящимися к К-краям поглощения благородных газов, которые в настоящий момент достаточно хорошо изучены. [11]
 |
Валентная электронная схема Ю. [12] |
Отметим еще раз, что, по-видимому, 90 % всех известных соединений могут быть представлены электронными структурами, включающими структуры благородных газов, и около 95 % веществ, изучаемых во вводных курсах химии, относятся к этой категории. Таким образом, так называемое правило октета, основанное на заполнении валентных 5р3 - орбиталей, весьма универсально. [13]
Интенсивность же селективных линий поглощения, вызывающих появление тонкой структуры края вблизи границы поглощения, может быть достаточно легко оценена для атомов или ионов, структура которых близка к структуре благородных газов. Именно к этой группе ионов относится большинство анионов в изученных до сих пор молекулах газов. [14]
Эти вещества имеют одноатомные молекулы, которые связаны друг с другом Ван-дер - Ваальсовыми силами. С этой точки зрения структуры благородных газов следует отметить в таблице так же, как и структуры VII - Ь подгруппы. [15]
Страницы: 1 2