Трехмерная структура - белок
Cтраница 1
Трехмерная структура белка еще ие известна. [1]
Трехмерная структура белка определяется невалентными взаимодействиями между аминокислотными остатками цепи, а также между этими остатками и растворителем ( гл. [2]
Трехмерная структура белка высокослецифична. Иными словами, полипептидная цепь или цепи не просто свертываются с образованием структуры, близкой к сферической; свертывание проходит ряд строго фиксированных этапов, в результате чего возникает уникальная или почти уникальная конфигурация. Ввиду большой сложности и высокой специфичности третичной структуры, естественно, очень важно, во-первых, изучить тонкие детали этой структуры и, во-вторых, попытаться понять природу сил, ответственных за ее поддержание. Данные по вязкости, коэффициенту трения и светорассеянию дают информацию относительно общей топографии макромолекул. Более точные сведения, касающиеся деталей третичной структуры белков, удается получить с помощью рентгеноструктурного анализа. [3]
 |
Пространственная конфигурация карбоксипептидазы ( а и рибонукле-азы ( б. [4] |
Для выяснения трехмерной структуры белков в последнее время успешно применяются также методы низкотемпературной вычислительной техники, а также математические и компьютерные методы определения объемной структуры на основании данных последовательностей аминокислот. [5]
Существенную помощь в подобных случаях оказывает знание трехмерной структуры белков. Имеющиеся в настоящее время данные показывают, что обычно остатки, находящиеся во внутренней части белка, мало подвержены изменениям и что все различия между гомологичными белками ( замены аминокислот, делеции или вставки петель в цепи) касаются поверхности молекул. Таким образом, последовательности отдаленно родственных белков можно сопоставлять по остаткам, которые занимают геометрически сходные позиции в пространственной структуре. [6]
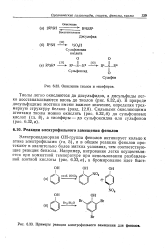 |
Примеры реакции электрофильного замещения для фенолов. [7] |
В природе дисульфидные мостики имеют важное значение, определяя трехмерную структуру белков ( разд. [8]
Проведенный им анализ дифракционной картины волокон кератина [74, 75] привел к простому представлению о трехмерной структуре белков, образованных в результате упаковки вытянутых ф-кератин) или изогнутых ( а-кератин) полипептидных цепей. В основе этого представления лежало два принципиальных положения: о возможности существования изогнутых форм полипептидных цепей, которые считались полностью растянутыми, и о существовании упорядоченной трехмерной структуры белков, составляющей основу упаковки. [9]
Характерной особенностью современных работ по конформа-ционному анализу полипептидов является расчет предпочтительной конформации с использованием трехмерных структур белков, установленных ранее с помощью рентгеноструктурного анализа, что позволяет проверить правильность расчета. Полученные результаты существенно разнятся по достоверности ввиду неопределенностей, связанных с установлением минимума энергии конформации молекулы, как это показано на примере полипептидов. [10]
Такие деформации, безусловно, могут иметь место в силу взаимодействия между субстратом и трехмерной структурой белка и, поскольку последний не является жестким образованием, его структура также будет деформироваться. Деформации стабильных структур основного состояния приводят к тому, что такого рода взаимодействия осуществляются с затратой энергии и понижают общую энергию связывания. [11]
Наконец, мы рассмотрим молекулярные основы самовоспроизведения клеток и преобразования одномерной информации, содержащейся в ДНК, в трехмерную структуру белков. По ходу дела мы увидим, что биохимия способствует формированию новых важных представлений, касающихся физиологии человека, проблем питания и медицины, более глубокому пониманию биологии растений, основ сельского хозяйства, эволюции, экологии, а также великого круговорота вещества и энергии между солнцем, землей, растениями и животными. [12]
Ти представляет собой лабильный трехдоменный белок с молеку - Цфной массой около 45 000 дальтон. Трехмерная структура белка находится в адии интенсивного исследования. [13]
Каждому белку свойственна своя особая геометрическая форма, или конформация. Для описания трехмерной структуры белков рассматривают обычно четыре уровня организации, которые мы здесь и опишем. [14]
Как известно, не все белки содержат цистин; однако имеются и другие возможности сшивки цепей, например при помощи фосфо-эфирных связей. Кроме того, следует иметь в виду, что трехмерная структура белка, несомненно, приводит к взаимодействию боковых цепей аминокислот друг с другом или с какими-либо участками пептидной цепи. Важную роль в образовании уникальной структуры белка, обеспечивающей его биологическую функцию, играют прочно связанные с ним вещества небелковой природы, такие, как металлы, пигменты и сахара. Молекула гемоглобина человека состоит из четырех пептидных цепей ( двух а - и двух ( З - цепей), соединенных с четырьмя геминовыми группами, которые и являются переносчиками кислорода. Структуры обеих цепей гемоглобина ( по Брауницеру и др. [1 ]) и миоглобина [2, 3] приведены на фиг. Интересно, что, согласно недавно опубликованной структуре субъединицы белка вируса табачной мозаики [4], в цепи из 158 аминокислотных остатков отсутствуют поперечные связи ( фиг. [15]
Страницы: 1 2 3