Существование - молекула
Cтраница 1
Существование молекулы установлено опытом, но положения термодинамики как науки не зависят от степени достоверности этого факта. Если бы завтра было доказано, что молекулы не существуют и вещество по своей природе является непрерывным, это не привело бы к каким-либо изменениям в термодинамической теории. В последующем изложении молекулы будут иметь малое значение, поскольку изложение термодинамики без учета молекул существенно упрощается. [1]
Существование молекул Li2, HF, H2O и NH3 подтверждает валентность 1 у лития и фтора, 2 у кислорода и 3 у азота. В таблице видно, что для изолированного атома углерода основным является двухвалентное состояние; для бора - одновалентное, а бериллий оказывается нульвалентным. Образование соединений, в которых атомы проявляют высшую валентность, требует энергетического возбуждения последних с переходом электрона на более высокий энергетический подуровень. [2]
Существование молекулы в форме имидазида ( называемого также азидо-азометином) или в изомерной тетразольной форме зависит от характера заместителей у атомов азота и углерода. [3]
Существование молекулы как единой химической частицы обусловливается наличием в ней отношений непосредственной химической связи между отдельными парами атомов. Эти отношения непосредственной химической связи, кратко - химические связи атомов - являются столь же реальными, действительными, объективно существующими, сколь реальной, действительной, объективно существующей является сама молекула. [4]
Существование молекул ДНК в циклической форме было впервые обнаружено при электронно-микроскопических исследованиях. Ковалентный характер связи в упомянутых выше соединениях доказывается неспособностью их подвергаться гидролизу под действием экзонуклеаз ( см. стр. Появление единичных разрывов в полинуклеотидной цепи циклических ДНК под действием эндодезоксирибонуклеаз приводит к характерным изменениям конформации молекул ( см. гл. [5]
Существование молекул ШО с ароматическими заместителями в виде устойчивых неплоских конформаций объясняет ряд их физических и химических особенностей. Если же неподеленная электронная пара на атоме азота использована для образования связи, она не может вступать в сопряжение. [6]
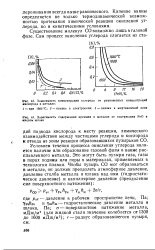 |
Зависимость концентрации углерода от равновесных концентраций кислорода в металле.| Зависимость содержания кремния в металле от содержания FeO в кислом шлаке. [7] |
Существование молекул СО возможно лишь в газовой фазе. [8]
Существование молекулы SiC доказано масс-спектрометрическими исследованиями Дроварта и др. [1406], однако спектр этой молекулы экспериментально не наблюдался. [9]
Существование позитронных молекул пока экспериментально не доказано. [10]
Возможно существование молекул с большим коэффициентом полимеризации. Крруиным, Херцогом, Оуэном, Ялманом и Суиннертоном [439] изучено гидротермальное превращение кремнеземистого стекла в кварц в условиях ] различной кислотности. Механизм превращений объясняется по Гиббсу. [11]
Невозможность существования молекулы Не2 иллюстрирует общее положение, что суперпозиция равного числа дважды заполненных связывающих и разрыхляющих орбиталей ведет или к несвязыванию, или даже к небольшому отталкиванию. [12]
Длительность существования молекул в организме невелика. Например, молекулы отдельных белков разрушаются через несколько суток после их образования, а за 3 месяца обновляется больше половины всех белков нашего тела Таким образом непрерывно обновляются все вещества, из которых состоят живые клетки. [13]
Продолжительность существования молекулы монохлорида составляет примерно 10 - 3 с. Он представляет собой высокомолекулярное соединение с чередующимися двойными связями и обладает аморфной структурой. При нагревании его цвет меняется от желтого ( на холоду) до оранжево-красного и он легко гидролизуется. При действии сухого кислорода он стабилен только в условиях комнатной температуры, при температуре выше 90 С монохлорид бурно сгорает. В отсутствие кислорода монохлорид устойчив и при небольшом нагревании, но выше 500 С разлагается полностью. [14]
О существовании молекул убедительно говорит закон кратных отношений веществ, вступающих в химическую реакцию. [15]
Страницы: 1 2 3 4