Существование - энергетический барьер
Cтраница 2
 |
Кривые распределения числа час -. [16] |
Для сближающихся коллоидных частичек преобладание молекулярных сил взаимодействия осуществляется на относительно больших ( силы дальнодействия) и очень малых расстояниях, в промежутке между которыми отталкивающие силы электростатической природы обусловливают существование энергетического барьера, обеспечивающего агрегативную устойчивость частичек. На величину энергетического барьера существенное влияние оказывают природа и концентрация электролита, вводимого в систему. [17]
 |
Этан ( промежуточные конформации тоже возможны. [18] |
Однако в начале 30 - х годов были получены данные, свидетельствующие об ошибочности такой точки зрения: в 1936 г. Питцер показал, что экспериментально найденные и рассчитанные термодинамические характеристики этана плохо согласуются, если не допустить существования энергетического барьера для свободного вращения вокруг простой С-С - связи, равного приблизительно 3 0 ккал / моль. [19]
Физическая теория стойкости ионостабилизированных дисперсных систем построена на образовании двойного электрического слоя из ионов на поверхности частичек. Это определяет существование энергетического барьера, который препятствует сближению одноименно заряженных частичек на расстоянии, где действуют интенсивные молекулярные силы притяжения. Такой электрический слой, внешняя оболочка которого имеет диффузионную природу, образуется вследствие ионизации молекул, которые составляют поверхностную оболочку твердой фазы, или в результате адсорбции на поверхности твердой фазы одного из ионов из раствора электролита. [20]
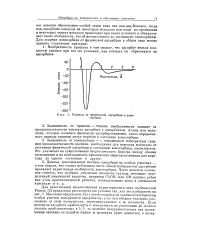 |
Переход от физической адсорбции к хемосорбции. [21] |
Зависимость от температуры - с повышением температуры средняя продолжительность времени, необходимая для перехода молекулы от состояния физической адсорбции к состоянию хемосорбции, уменьшается. Это указывает на существование энергетического барьера между обоими состояниями и на необходимость преодоления энергии активации для перехода из одного состояния в другое. [22]
Многие соединения типа R3Si X и R4Si могут быть перегнаны при температурах выше 200 без потери оптической активности. Это свидетельствует о существовании значительного энергетического барьера, препятствующего искажению тетраэдрических углов. [23]
Кроме изложенного выше, следует указать ряд дополнительных обстоятельств, которые могут затруднять процессы конденсации и испарения. В качестве первого можно упомянуть возможность существования энергетического барьера, который приближающаяся молекула должна преодолеть, чтобы попасть в область притяжения поверхностных молекул. Все слишком медленные молекулы вернутся обратно, и только их доля а ехр ( - u / kT) будет конденсироваться. [24]
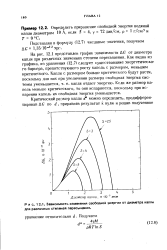 |
Зависимость изменения свободной энергии от диаметра капли для различных степеней пересыщения. [25] |
На рис. 12.1 представлен график зависимости АС от диаметра капли при различных значениях степени пересыщения. Как видно из графика, из уравнения (12.7) следует существование энергетического барьера, препятствующего росту капель с размером, меньшим критического. Если же размер капель меньше критического, то они испаряются, поскольку при испарении капель их свободная энергия уменьшается. [26]
Большие симметричные комплексные ионы ( например, [ Fe ( GN) e ] 3 - - [ Fe ( GN) e ] 4) обмениваются гораздо быстрее, чем маленькие ненасыщенные ионы ( например, Fe g - Felq); этот вопрос был рассмотрен впервые Либби [166] на основании принципа Франка - Кондона следующим образом. Когда электрон перескакивает мгновенно от одного иона к другому, координационные сферы должны приспособиться к их новому окружению; сравнительно медленное приспособление координационных сфер и является причиной существования энергетического барьера для всего процесса переноса электрона. В случае небольших ионов, содержащих в своей первой координационной сфере растворитель, требуется значительная переориентация растворителя, и поэтому энергетический барьер оказывается высоким. С другой стороны, структуры комплексных ионов типа цианидов железа в двух окислительных состояниях настолько сходны, что необходима лишь небольшая перегруппировка, и перенос электрона происходит довольно быстро. [27]
Путем гофрировки слоев ъ такой структуре можно непосредственно перейти к кубическому BN, построенному по. Следовательно, такой переход невозможен без разрыва ковалентных связей В-N в слое. Последнее указывает на существование значительного энергетического барьера. [28]
Позднее Аддисон [30] сочетал методы измерения поверхностного давления и поверхностного натяжения методом Виль-гельми [31] по отрыву пластин и при их помощи установил, что динамическое поверхностное натяжение больше его статического значения, отвечающего тому же покрытию поверхности. Для объяснения этого явления автор высказывает предположение, что в начальные моменты адсорбции адсорбируемые молекулы находятся на границе раздела в неориентированном состоянии и только с течением времени адсорбированный слой приобретает строго ориентированное состояние. Сопоставляя скорости адсорбции и десорбции, Аддисон постулирует существование энергетического барьера для обоих процессов. Он нашел, что скорость десорбции молекул зависит от поверхностной концентрации и молекулярного веса сорбата и при длинной цепи более семи атомов углерода протекает так быстро, что ее не представляется возможным измерить. [29]
Согласно модели Бьеррума, ионы, расстояние между которыми в среде с D 23 не превышает 12 А, образуют ионную пару. Взгляд на этот растворитель уже не как на континуум, а скорее как на реальные молекулы выявляет два момента, которые не учитывались в моделях разд. Вытеснение последней молекулы растворителя требует частичной десольватации, что является причиной существования энергетического барьера. В обратном процессе разделения ионов, находящихся в контакте, барьер возникает из-за необходимости создания свободного пространства между ионами, что должно увеличить молекулярный объем до того, как молекула растворителя сможет занять его. [30]
Страницы: 1 2