Существование - внутримолекулярная водородная связь
Cтраница 1
Существование внутримолекулярных водородных связей впервые было отмечено при установлении особой устойчивости моноанионов дикарбоновых кислот. Стабилизация водородной связью проявляется в увеличении константы диссоциации Kt свободной кислоты и уменьшении константы диссоциации моноаниона К2 по сравнению с кислотами, в которых образование водородной связи невозможно. [1]
Намного более обоснованы доказательства существования внутримолекулярной водородной связи между карбоксильными группами в воде. Образование такой связи облегчается тем, что при этом нет потерь в энтропии ассоциации, которые необходимы для сближения молекул в растворе. Однако на самом деле существование внутримолекулярной водородной связи не доказывает того, что водородная связь между карбоксильными группами, одна из которых находится в ионизированном состоянии, обладает заметно большей прочностью в воде, потому что эти связи обнаруживаются только в тех молекулах, структура которых почти полностью исключает отсутствие водородной связи. [2]
На основании инфракрасного спектра установлено существование внутримолекулярной водородной связи. То, что две связи С-О не равны, служит доказательством, что атом водорода ОН-группы связан с одним из атомов кислорода, а не распределен равномерно между обоими атомами кислорода, как считали согласно более старой гипотезе. [3]
Такое отступление от установленных закономерностей объяснимо, если предложить существование внутримолекулярной водородной связи карбонильным и эндоциклическим атомами кислорода. [4]
Эти выводы могут быть получены менее формальным путем из предположения о существовании внутримолекулярной водородной связи между кислородом и кислым водородом в формах сопряженной кислоты ( см. стр. Легко видеть, что образованию водородной связи в ионе эфедриния препятствует отталкивание фениль-ной и метальной групп ( ср. Аналогичные соображения применимы также к хинину и его стереоизомерам. [5]
Эти выводы могут быть получены менее формальным путем из предположения о существовании внутримолекулярной водородной связи между кислородом и кислым водородом в формах сопряженной кислоты ( см. стр. Легко видеть, что образованию водородной связи в ионе эфедриния препятствует отталкивание фениль-ной и метильной групп ( ср. Аналогичные соображения применимы также к хинину и его стереоизомерам. [6]
Конформер LVI с внутримолекулярной водородной связью преобладает в неполярных растворителях ( гептан, четырех-хлористый углерод); в спектрах кругового дихроизма при этом наблюдается интенсивный положительный сигнал ( молекулярная эллиптичность [6] 28з 36 100); существование внутримолекулярной водородной связи подтверждается инфракрасными спектрами. [7]
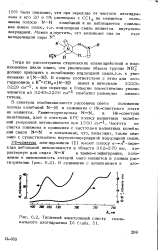 |
Типичный электронный спектр геми-нального азогидразина 16 ( 5. [8] |
В спектрах комбинационного рассеяния света положение полосы колебаний N - Н в сравнении с ИК-спектрами почти не меняется. Частота ее слегка понижена в сравнении с частотами валентных колебаний связи NN в азоапканах, что, возможно, также связано с существованием внутримолекулярной водородной связи. [9]
Конформационными факторами объяснены изменения спектров КД у соединений, в которых возможно взаимодействие двух функциональных групп. Конформер ( 174) с внутримолекулярной водородной связью преобладает в неполярных растворителях ( гептан, тетрахлорид углерода); в спектрах КД при этом наблюдается интенсивный положительный сигнал ( молекулярная эллиптичность [0] 28з 36 100); существование внутримолекулярной водородной связи подтверждается ИК-спектрами. При переходе к растворителям, разрывающим внутримолекулярную водородную связь, преобладающей становится отрицательная полоса ( в метаноле [6] 2б8 4220и [0] 3об - 13 000), что связано со сдвигом конформационного равновесия в сторону ф2 - конформера. Дополнительным подтверждением такого толкования служит тот факт, что ( S) - ( -) - 3-метокси - З - фенилбутанон-2 ( 173; R Me), не способный к образованию внутримолекулярной водородной связи, имеет отрицательную полосу КД как в гептане, так и в метаноле. [10]
Намного более обоснованы доказательства существования внутримолекулярной водородной связи между карбоксильными группами в воде. Образование такой связи облегчается тем, что при этом нет потерь в энтропии ассоциации, которые необходимы для сближения молекул в растворе. Однако на самом деле существование внутримолекулярной водородной связи не доказывает того, что водородная связь между карбоксильными группами, одна из которых находится в ионизированном состоянии, обладает заметно большей прочностью в воде, потому что эти связи обнаруживаются только в тех молекулах, структура которых почти полностью исключает отсутствие водородной связи. [11]
Центральная часть потенциальной поверхности многоатомной нежесткой молекулы имеет несколько минимумов, соответствующих различным стационарным конфигурациям молекулы. Энергетически наиболее выгодный путь, соединяющий эти минимумы, определяет характер внутреннего вращения. Если в состав молекулы входят протонодонорные и протоноакцепторные группировки и в некоторых конформациях между ними возможно взаимодействие через атом водорода, то это сказывается на ряде физических и химических свойств молекулы, что позволяет говорить о существовании внутримолекулярной водородной связи. В случаях, когда таких конформации несколько, энергия внутримолекулярной связи зависит от выбора конечного состояния. [12]
Центральная часть потенциальной поверхности многоатомной нежесткой молекулы имеет несколько минимумов, соответствующих различным стационарным конфигурациям молекулы. Энергетически наиболее выгодный путь, соединяющий эти минимумы, определяет характер внутреннего вращения. Если в состав молекулы входят протонодонорные и протоноакцепторные группировки и в некоторых конформациях между ними возможно взаимодействие через атом водорода, то это сказывается на ряде физических и химических свойств молекулы, что позволяет говорить о существовании внутримолекулярной водородной связи. Энергией внутримолекулярной связи называют обычно разность энергий этой конформации и какой-нибудь другой стабильной конформации, в которой возможность непосредственного взаимодействия между донорной и акцепторной группами отсутствует. В случаях, когда таких конформации несколько, энергия внутримолекулярной связи зависит от выбора конечного состояния. [13]
Страницы: 1