Анион - аминокислота
Cтраница 1
Анионы аминокислот образуют устойчивые комплексы со многими ионами металлов, в частности с ионами переходных элементов. В большинстве случаев аминоацидаты взаимодействуют как бидентатные лиганды, координируясь через амино - и карбоксильную группы. Такие аминокислоты, как глицин, аланин, валин, про-лин, лейцин, саркозин, тирозин [88], серии [87], треонин [87], лизин [89, 90], аргинин [22, 89, 91], триптофан, аспарагин и ме-тионин, по отношению к Ni2, Cu2 и Zn2 ведут себя как бидентатные лиганды. Сходство констант устойчивости их комплексов с Zn2, Fe2 и Fe3 ( табл. 2.12) указывает, что они все координируются только через амино - и карбоксильную группы. [1]
О % с анионами JV-защищенных аминокислот и, следовательно, может применяться для их активации в синтезе пептидов. [2]
Прочность комплексных соединений с анионами аминокислот возрастает в ряду: глицин, гистидин, цистеин. [3]
 |
Схема клеточной мембраны.| Схема установки для исследования электрохимических свойств липидных бисло-ев ( а и структура липидного бислоя ( б. [4] |
Дефицит неорганических анионов, необходимый для поддержания электронейтральности, покрывают органические анионы, вероятно, анионы аминокислот. Опытами с изотопом калия обнаружена способность внутриклеточных ионов К к практически полному обмену. Разность потенциалов на клеточной мембране зависит от разности концентраций ионов во внутренней части клетки и в окружающей ее среде, а также от проницаемости мембраны. [5]
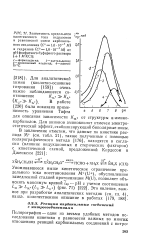 |
Зависимость предельного кинетического тока гидразонов в равновесной смеси карбонильного соединения ( С 1 0 10 - М и гидразина ( С 1 0 10 - 3 М от рН фосфатного буферного раствора ( 1ЛГКС1. [6] |
Ки КА В работе [220] была показана применимость уравнения Тафта для описания зависимости / См от структуры а-амино-карбинолов. Для анионов аминокислот отмечен электростатический эффект, стабилизирующий биполярные ионы. [7]
 |
Кривые хронокондукто-метрического титрования раствором НС1 смесей NaOH, анилина и хромата натрия с аминокислотами. [8] |
Смеси электролитов основного характера могут содержать цвиттер-ионы, сильное основание, слабое основание и соли слабых кислот. При взаимодействии с НС1 сначала нейтрализуется избыток NaOH, затем нейтрализуются аминогруппы в анионах аминокислот, что приводит к образованию цвиттер-ионов. Если в смесь кроме этого входит анилин, он нейтрализуется последним. Кривые титрования имеют соответственно три или четыре излома. Изменение электропроводности раствора от избытка тит-ранта носит нелинейный характер, что объясняется, как рассмотрено ранее, влиянием реакции вытеснения карбоксильных групп в цвиттер-ионах. [9]
При сорбционном выделении аминокислот их соли получают десорбцией из анионитов растворами оснований. Если необходимо очистить соль от анионов других кислот ее раствор дополнительно пропускают через анионит в форме аниона аминокислоты. Эти способы описаны в работе [48] применительно к получению глутамата натрия. [10]
Катион [ V ( H2O) 6 ] 3 устойчив только в не содержащих кислорода кислых растворах. В этих условиях V3 образует довольно большое число комплексных соединений, в том числе такие, в которых лигандами служат анионы Cl -, SO -, C2O - и анионы аминокислот. [11]
Тот факт, что отношение fcj / fcj становится меньше единицы при рН 8 48, объясняется образованием водородной связи между катионом BzPVP и DMSO и повышением нуклеофильности аминогрупп. Как видно из рис. 3.9, в отсутствие катионных полимерных добавок аминокислота взаимодействует с DMSO, а в системах с добавками осуществляется ориентация DMSO, поскольку водородная связь, соответствующая аниону аминокислоты, разрывается. [13]
Роль переходных металлов в жизнедеятельности организмов в основном опеределяется их каталитическими свойствами. Кофермент может представлять собой органическую молекулу, например флавин, пиридоксаль, пиридиннуклеотид и др., соединенную с белком ко-валентной связью, водородными связями или за счет вандервааль-совых взаимодействий. Кофактор может быть простым ионом металла, например ионом меди, или комплексом металла с одним или несколькими лигандами, например железопорфирины, кобальт-корриноиды. Если с ионом металла координируется один или несколько анионов аминокислот, то лигандом может служить сам белок, хотя это лиганд необычного типа. Очевидно, такие металло-ферменты можно рассматривать как особую группу ферментов или как особую группу комплексов металлов и сопоставлять каталитическую активность ферментов, содержащих и не содержащих металл, или каталитическую активность комплексов переходного металла с белком и без белка. Предметом обзора являются такие металлопротеины, которые сами претерпевают определенные ( например, окислительно-восстановительные) превращения в ходе каталитического процесса и в которых в качестве лигандов принимают участие некоторые специфические компоненты, например молекулярный кислород, которые характерны для комплексов переходных металлов. [14]
Страницы: 1