Потенциометрическое измерение
Cтраница 3
Метод потенциометрического измерения концентрации ионов в растворе основан на измерении разности электрических потенциалов двух специальных электродов, помещенных в испытуемый раствор, причем один электрод-вспомогательный - в процессе измерения имеет постоянный потенциал. [31]
Метод потенциометрического измерения концентрации ионов в растворе основан на измерении разности электрических потенциалов двух специальных электродов, помещенных в испытуемый раствор, причем один электрод - вспомогательный - в процессе измерения имеет постоянный потенциал. [32]
При потенциометрических измерениях рН стандартного буферного раствора, применяемого для калибровки, обычно определяется активностью ионов водорода, и поэтому результат определения ионов водорода также выражается в единицах активности. Если анализируемый раствор имеет высокую ионную силу, искомая концентрация ионов водорода будет заметно отличаться от измеренной активности. [34]
В потенциометрических измерениях применяют и другие, более сложные коммутаторы с автоматическим управлением. [35]
При потенциометрических измерениях активность контролируемых ионов в растворе определяют с помощью измерительной системы из двух электродов: измерительного, потенциал которого является функцией активности этих ионов, и электрода сравнения ( каломельного или галогеносеребряного) с постоянным потенциалом. Электродвижущая сила измерительного элемента равна алгебраической сумме потенциалов обоих электродов. При определении значения рН растворов широко используется стеклянный электрод, обладающий рядом преимуществ перед другими типами измерительных электродов. При погружении в водный раствор электролита стеклянный электрод в результате обмена ионами с раствором приобретает свойства водородного электрода. При этом на границе стекло - раствор возникает разность потенциалов, соответствующая значению рН анализируемого раствора. [36]
При потенциометрических измерениях получают непосредственно термодинамические данные, но этот метод применим лишь к обратимым реакциям. Большинство электрохимических реакций в действительности не являются обратимыми. Следовательно, хотя с помощью потенциометрических измерений получено много важных термодинамических данных, этот метод не может быть использован для изучения сложных электродных реакций. [37]
При потенциометрических измерениях чрезвычайно важно контролировать температуру, желательно с точностью 0 01 С, но не менее 0 05 С. В работе [9] показано, что если температура изменяется более чем на 0 02 С, то ошибка в определении активностей составляет 0 5 z %, где z - число электронов. В связи с необходимостью точного контроля температуры желательно использовать бюретки с водяными рубашками для титрования при температурах, сильно отличающихся от комнатных. [38]
При потенциометрических измерениях пробу газа вводят в электролитический буферный раствор и, при помощи ион-чувствительной пары электродов, измеряют изменение концентрации ионов, вызываемое тестируемыми компонентами. [39]
 |
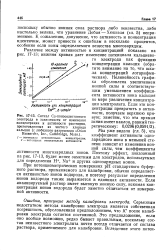
Схема установки для потенциометрических измерений на приборе ЛПУ-01. [40] |
При потенциометрических измерениях на приборе ЛПУ-01 с датчиком ДЛ-01 можно применять различные измерительные электроды, в том числе металлические. [41]
 |
Кювета, оборудованная электродами. [42] |
Параллельно проводились потенциометрические измерения. Анодный ключ своим длинным носиком проникает через специальное отверстие в катоде, диаметром в 2 мм и опирается на анод. Другим концом ключ погружается в стаканчик с раствором соответствующего электролита. [43]
Напротив, потенциометрические измерения Розенгейма [ 1в ] указывают на образо-вание устойчивого мета-вольфрамат-аниона в растворе. [44]
Для проведения потенциометрического измерения ячейку, состоящую из электрода, потенциал которого хотят измерить ( индикаторный электрод), и вспомогательного электрода, потенциал которого известен ( электрод сравнения), включают в схему, измеряющую электродвижущую силу. [45]
Страницы: 1 2 3 4