Усиление - неметаллические свойство
Cтраница 2
 |
Число элементов в периодах. [16] |
Каждый период ( кроме первого) начинается активным щелочным металлом и заканчивается галоидом и следующим за ним инертным газом. Эти изменения происходят крупными скачками в малых периодах и более мелкими скачками - в больших. Кроме того, в больших периодах изменение химических свойств элементов происходит несколько своеобразно. Например, в четвертом периоде ослабление металлических свойств происходит лишь, у первых семи элементов ( от К до Мп), затем наблюдается временное усиление металлических свойств ( от Fe до Си), после чего вновь продолжается ослабление металлических и усиление неметаллических свойств. Подобная закономерность наблюдается во всех больших периодах. Максимумы металлических свойств в середине больших периодов приходятся на Си, Ag и Аи. В рамках каждой подгруппы периодической системы наблюдается закономерное усиление металлических свойств с увеличением атомного номера. [17]
 |
Расположение металлов и неметаллов в Периодической системе элементов Д. И. Менделеева. [18] |
При переходе от одного элемента к другому в подгруппе или периоде Периодической системы Д. И. Менделеева наблюдается плавное изменение металлических и неметаллических свойств. Эта закономерность была показана выше на примере сравнения свойств простых веществ элементов главной подгруппы V группы: N, Р, As, Sb, Bi. Например, в третьем периоде ( Na, Mg, Al, Si, P, S, Cl, Ar); натрий - типичный металл, магний и алюминий - металлы, кремний-неметалл, однако по внешнему виду и некоторым свойствам он напоминает металлы, а фосфор, сера, хлор и аргон - типичные неметаллы. Таким образом, в периоде слева направо происходит усиление неметаллических свойств элементов и ослабление металлических свойств. [19]
Атомы могут не только отдавать, но и присоединять электроны. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону; при этом образуется соответствующий анион. Ьбычно сродство к электрону ( Е), как и энергию ионизации, выражают в электронвольтах. Величины сродства к электрону известны не для всех элементов, их измерить весьма трудно. Наибольшие значения этих величин у галогенов, так как на внешнем уровне их атомов находится по 7 электронов ( табл. 6), что указывает на усиление неметаллических свойств элементов по мере приближения к концу периода. [20]
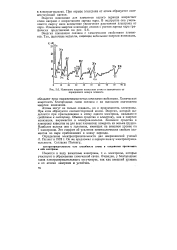 |
Изменение энергии ионизации атома в зависимости от порядкового номера элемента. [21] |
Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. [22]
Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Величины сродства к электрону известны не для всех элементов, их измерять весьма трудно. Наибольшие значения этих величин имеют галогены, у которых на внешнем уровне находится по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода. [23]
Страницы: 1 2