Термодинамические возможности
Cтраница 1
Термодинамические возможности таких механизмов разбираются в следующих главах. [1]
Термодинамические возможности метода вакуум-плавления очень велики. Даже если весь кислород в пробах металла связан с такими сильными раскислите-лями, как алюминий, то окислы должны полностью восстанавливаться углеродом. Это подтверждает следующий расчет. [2]
Какая из этих реакций имеет наибольшие термодинамические возможности и как можно ( изменяя Р и Т) способствовать протеканию основной реакции. [3]
Причем температуру и давление следует изменять так, чтобы термодинамические возможности реакции в данном направлении возрастали. При / Ср J 1 реакция будет практически неосуществимой в прямом направлении при всех условиях, доступных обычному опыту, а при / Ср 1, наоборот, реакция будет возможной только в прямом направлении. [4]
Мы еще не располагаем прогнозирующей теорией, которая позволила бы более полно использовать термодинамические возможности в исходных химических компонен-тах что не позволяет гальваническим и топливным элементам занять видное место в энергетическом балансе общества. [5]
Обычно реакции протекают термодинамически необратимо, поэтому величина AZ в таких случаях характеризует лишь термодинамические возможности реакции, ее работоспособность, но не самую работу, которую совершает реакция при действительном ее течении, например в колбе. [6]
Если снизить энергию активации системы, например, введением катализатора, то она реализует свои термодинамические возможности мгновенно - со взрывом. [7]
Итак, возможность, направление и предел течения изобарно-или изохорно-изотермического процессов в неизолированной системе определяется знаком разности AG G2 - Gb а термодинамические возможности этого процесса - абсолютной величиной этой разности. [8]
Таким образом, возможность, направление и предел течения изобарно-изотермических процессов в неизолированной системе определяются знаком разности AZ Z2 - Zlt а термодинамические возможности этого процесса - абсолютной величиной этой разности. [9]
 |
Энергетическая диаграмма реакции. [10] |
Дело в том, что для протекания реакции мало запаса энергии - необходима возможность реального пути, механизма, который и реализует термодинамические возможности химической системы. Огромная энергия, заключенная в недрах Земли, к счастью, очень редко проявляет себя в виде землетрясений или извержений. Она дремлет, так как отсутствует механизм протекания процесса. Камень может сотни лет пролежать на склоне без движения. Но если неосторожный путник заденет его, реакция может вырасти в камнепад, лавину, обвал. Нашелся механизм процесса и начальный импульс, На языке химии это именуется активацией процесса, а энергия, необходимая для начала реакции, - энергией активации. [11]
Рассматривая вопрос о возможности химической реакции, необходимо учитывать, что реакция при заданных условиях может не идти в данном направлении по следующим причинам: а) ее незначительные термодинамические возможности; б) значительные кинетические препятствия; в) по причинам а) и б), вместе взятыми. [12]
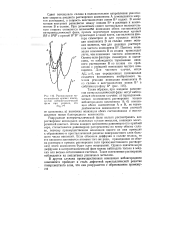 |
Расположение потенциальных кривых компонентов янтерметаллической фазы при условии, что. [13] |
Таким образом, при анодном равновесии иитерметаллической фазы могут наблюдаться несколько случаев: а) термодинамическая возможность растворения только неблагородного компонента А; б) ионизация обоих компонентов А и В, но термодинамические возможности этих реакций не одинаковы; в) возможна ионизация обеих составляющих и восстановление ионов благородного компонента. [14]
Таким образом, чтобы обоснованно судить о скорости электрохимического коррозионного процесса из теоретических предпосылок, необходимо в первую очередь, знать величины равновесных потенциалов анодных и катодных процессов в условиях коррозии, что определит термодинамические возможности коррозии ( уменьшение свободной энергии системы при протекании коррозии) и электрохимическую кинетику протекания анодных и катодных процессов, зависящую от степени их заторможенности или поляризуемости. В отдельных случаях приходится учитывать также и омический фактор. [15]
Страницы: 1 2