Адсорбция - ион - иод
Cтраница 1
Адсорбция ионов иода из растворов KI, по-видимому, подчиняется более простой закономерности в формамиде, чем в воде. [1]
Как следует из рис. 132, который иллюстрирует влияние адсорбции иона иода на кривые заряжения, с ростом концентрации этого аниона количество хемосорбированного водорода заметно снижается. Измерения вольта-потенциалов [ 1а, 3 ] подтверждают эту точку зрения. [2]
Уравнение ( 4 34) было проверено при исследовании адсорбции ионов иода и органических молекул. [3]
Это уравнение неоднократно подвергалось экспериментальной проверке на примере изучения адсорбции ионов иода на диализированных золях иоди-да серебра. [4]
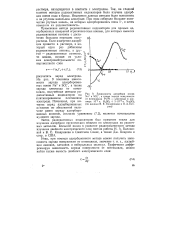 |
Зависимость адсорбции ионов Na и SO -, а также заряда поверхности от потенциала Pt / Pt - электрода в растворе Ю-3 н. H2SO4 3 - Ю-51 н. Na2SO4 ( по данным В. Е. Казаринова и О. А. Пет-рия. [5] |
Так, на гладкой платине методом радиоактивных индикаторов была изучена адсорбция ионов иода и брома. Измерения данным методом были выполнены и на ртутном капельном электроде. [6]
Из полученных результатов следует, что предположение об эквивалентном вытеснении адсорбированного водорода адсорбирующимися ионами, которое используется при определении адсорбции ионов на платиновых металлах [35], в случае адсорбции ионов иода и брома не оправдывается. [7]
Одним из проявлений этого различия является, по-видимому [4, 9], необычный характер изменения Ei /, волны восстановления нитрометана в кислой среде, которая наблюдается при потенциалах положительной ветви электрокапиллярной кривой у точки нулевого заряда, где имеет место сильная адсорбция ионов иода. Одновременно вследствие адсорбции ионов иода наблюдается отрицательный сдвиг потенциала на внутренней ] плоскости Гельмгольца - Дф [, причем противоположные по знаку изменения Дг и - Дг приблизительно одинаковы по абсолютной величине. [8]
Рассмотренные выше данные указывают на роль электростатических факторов в явлениях совместной адсорбции ионов раствора и атомов водорода и кислорода на поверхности платиновых металлов. Стерические факторы наиболее ярко проявляются при адсорбции ионов иода на поверхности платиновых металлов. [9]
Эти эффекты могут быть качественно истолкованы, учитывая вызываемое адсорбцией анионов изменение 1 -потенциала. Однако, как показали Я. М. Колотыркин и Л. А. Медведева [59], в случае свинца действие адсорбированных слоев галоидов уже явно не может быть сведено к изменению - потенциала, поскольку адсорбция иона иода на свинце в некотором интервале концентраций не ускоряет, а тормозит разряд иона водорода. Последний эффект указывает на снижение энергии адсорбции водорода в результате насыщения поверхностных валентностей металла при хемосорбции иода. [10]
Как легко видеть, полученные экспериментальные данные полностью соответствуют положениям теории замедленного разряда. Так, например, адсорбция поверхностно-активного катиона тетраэтшшммония ( рис. 63, 6 увеличивает перенапряжение водорода в области потенциалов, где поверхность имеет отрицательный заряд. Небольшое понижение перенапряжения в интервале плотностей тока 10 - 5 - МО-3 а / см2, вероятно, связано с адсорбцией иона иода на положительно заряженной поверхности германия. [11]
 |
Схема прибора для измерения адсорбции при помощи радиоактивных индикаторов по ме - Рис - 9 - Зависимость адсорбции истоду Казаринова. нов Na и5Од -, а также заряда по. [12] |
Метод радиоактивных индикаторов применим к электродам с ра шитыми поверхностями. В противном случае радиоактивный фон оказывается значительно выше, чем радиоактивность адсорбированных ионов. Однако для сильно адсорбирующихся ионов можно использовать, этот метод и на гладких электродах при этом одновременно необходимо свести к минимуму количество радиоактивного раствора, находящегося в контакте с электродом. Так, на гладкой платине методом радиоактивных индикаторов была изучена адсорбция ионов иода и брома. [13]
Страницы: 1