Адсорбция - водяной пар
Cтраница 2
При адсорбции водяных паров из воздуха активным глиноземом скорость теплового фронта обычно выше скорости адсорбционного фронта. Поэтому наблюдается заметное нагревание адсорбента, что приводит к снижению величины адсорбции. [16]
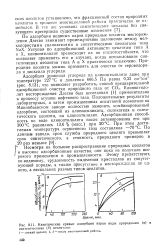 |
Кинетические кривые адсорбции паров воды природными ( о и. [17] |
По адсорбции водяных паров природные цеолиты месторождения Дзегви занимают промежуточное положение между мелкопористыми силикагелями и синтетическими цеолитами типа NaX. Уступая по адсорбционной активности цеолитам типа А и X, клиноптилолит превосходит их по кислотостойкое, что позволяет применять его в случаях, когда использование синтетических цеолитов типа А и X практически исключено. [18]
Изучение адсорбции водяного пара усложняется рядом особенностей, и, по-видимому, применение уравнения БЭТ к изотермам воды довольно часто не имеет реальных оснований. В работе [68] указывалось, что значение / 4т10 6 А2, рассчитанное с помощью уравнения (2.64) по плотности жидкости при 24, довольно хорошо согласуется с результатами определения удельной поверхности образцов кварца, анатаза и сульфата бария при адсорбции азота. Значение Ат, равное 14 8 А2, приводит в случае других твердых тел к слишком высоким при адсорбции воды результатам по сравнению с результатами, полученными для азота. [19]
Изотермы адсорбции водяных паров поднимаются очень круто при низких парциальных давлениях и почти в 4 - 5 раз превышают активность силикагеля и алюмогеля при адсорбции в этих условиях. Цеолиты могут адсорбировать 19 % вес. Это свойство они сохраняют и при высоких температурах. [20]
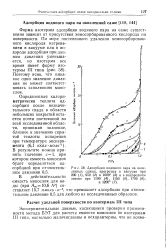 |
Адсорбция водяного пара на окисленных сажах, прогретых в вакууме при 200 ( 1, 950 ( 2 и 1000 ( 3 и в водородном потоке при 1100 ( 4, 1150 ( 5, 1700 ( б, и 3200 ( 7. [21] |
Форма изотермы адсорбции водяного пара на саже существенно зависит от присутствия хемосорбированного кислорода на поверхности. Поэтому ясно, что никакое одно значение давления не может соответствовать заполнению монослоя. [22]
В случае адсорбции водяных паров вещество меняет свои свойства - пластифицируется. Вода является понизителем твердости - пл астнфикатором. [23]
Изучена кинетика адсорбции водяного пара силикагелем и активным глиноземом при скоростях воздуха 0, 25 и 0 5 л / мин-см 2, начальной концентрации водяного пара 7 1 мг / л и температуре 18 С. Установлено, что в кинетике адсорбции водяного пара активным глиноземом решающую роль играет внутренняя диффузия, а в кинетике адсорбции водяного пара силикагелем - внешняя диффузия. Определены величины кинетических коэффициентов обоих адсорбентов. [24]
Изучена динамика адсорбции водяного пара активным глиноземом и силикагелем. [25]
Измерены изотермы адсорбции водяного пара глиноземом и силикагелем при температурах 0; 10; 30 С. [26]
 |
Зависимость к. р. п. от количества адсорбированных паров воды, в - число молекулярных слоев. [27] |
В отличие от адсорбции водяных паров на чистой поверхности адсорбция паров воды на поверхности германия, покрытой окисной пленкой, как видно из рис. 72, приводит к необратимым изменениям поверхностных свойств. [28]
Он сопоставил изотермы адсорбции водяного пара и азота на двух образцах сахарного угля ( графитированного и неграфитированного), выразив величину адсорбции в виде объема жидкого адсорбата в расчете на грамм угля. Из рис. 119 видно, что изотермы адсорбции азота относятся к изотермам I типа, а изотермы водяного пара - к изотермам V типа. [29]
Изучены [186] изотермы адсорбции водяных паров на порошке хлорида натрия. Показано, что механизм слеживания соли заключается в агрегировании частиц NaCl силами сцепления адсорбированной воды. [30]
Страницы: 1 2 3 4 5