Адсорбция - поверхностно активное вещество
Cтраница 1
Адсорбция поверхностно активных веществ, меняя величину и знак - - потенциала, может существенно влиять на скорость электрохимической реакции. [1]
Адсорбция поверхностно активных веществ как фактор, влияющий на кинетику электродных процессов, подробно рассматривалась в предыдущих главах. Здесь достаточно указать, что адсорбционный слой, тормозящий разряд металлических ионов, неминуемо должен тормозить и обратную реакцию ионизации, причем каждое поверхностно активное вещество должно по-разному влиять на электрокристаллизацию и анодное растворение металла. Такой вывод вполне естествен, поскольку сама адсорбция поверхностно активных веществ, а значит, и состояние адсорбционного слоя, как правило, зависят от потенциала ионного слоя. Поэтому влияние одного и того же вещества на процессы электрокристаллизации и растворения металлических ионов, особенно при больших поляризациях, может оказаться резко различным. Наиболее вероятно проявление подобных различий в тех случаях, когда равновесный потенциал электрода лежит вблизи его потенциала нулевого заряда. [2]
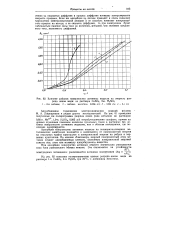 |
Влияние добавок поверхностно активных веществ на сморость разряда ионов меди. из раствора CuSO4, 2-я. H2SO4. / - без добавок. 2 - добавка желатина 0 0066 г / л. 3 - 0 066 г / л. 4 - 0 1 г / л. [3] |
Адсорбция поверхностно активных веществ на поликристаллических металлических электродах находится в зависимости от поверхностной энергии на отдельных гранях кристаллов и поверхностной энергии на ребрах и вершинах кристаллов. По мнению Лагагмьюра, каждый поверхностный атом металла служит адсорбционным центром, способным поверхностной энергией связать ион, атом или молекулу адсорбируемого вещества. [4]
 |
Микрошлиф осадка меда, полученного. [5] |
Адсорбция поверхностно активных веществ заметно влияет на структуру катодного осадка и на вид его поверхности. [6]
Адсорбция поверхностно активных веществ, меняя величину и знак - фгпотенциала, может существенно влиять на скорость электрохимической реакции. [7]
Адсорбция поверхностно активных веществ как фактор, влияющий на кинетику электродных процессов, подробно рассматривалась в предыдущих главах. Здесь достаточно указать, что адсорбционный слой, тормозящий разряд металлических ионов, неминуемо должен тормозить и обратную реакцию ионизации, причем каждое поверхностно активное ( вещество должно по-разному влиять на электрокристаллизацию и анодное растворение металла. Такой вывод вполне естествен, поскольку сама адсорбция поверхностно активных веществ, а значит, и состояние адсорбционного слоя, как правило, зависят от потенциала ионного слоя. Поэтому влияние одного и того же вещества на процессы электрокристаллизации и растворения металлических ионов, особенно при больших поляризациях, может оказаться резко различным. Наиболее вероятно проявление подобных различий в тех случаях, когда равновесный потенциал электрода лежит вблизи его потенциала нулевого заряда. [8]
Адсорбция поверхностно активных веществ ( ПАВ) на границе раздела фаз электрод - электролит отличается закономерностями, которые выделяют ее из известного раздела физической химии, изучающего адсорбционные явления, наблюдаемые в равновесных условиях на границе двух фаз. [9]
Адсорбция поверхностно активных веществ на границе раздела фаз электрод - электролит является важным фактором, определяющим кинетику и механизм электродных процессов. ПАВ способны в сотни и тысячи раз ускорять или замедлять скорость электродных реакций, изменять структуру катодных отложений, влиять на величину выхода по току. Именно этим объясняется большой интерес ученых-электрохимиков к изучению адсорбции ПАВ на электродах. [10]
 |
Ориентация адсорбированных молекул поверхностно активного вещества. [11] |
При адсорбции поверхностно активных веществ углем или силикагелем имеет место различная ориентация молекул адсорбированного вещества. [12]
Если даже проблема адсорбции поверхностно активных веществ и будет как-нибудь решена, все же сомнительно, чтобы добавки к нагнетаемой воде с целью повышения эффективности вытеснения нефти получили применение. [13]
В случае пористых адсорбентов адсорбция поверхностно активных веществ из растворов в слабоадсорбирующемся растворителе часто сопровождается плотным заполнением микропор растворенным веществом. [14]
Повышение катодной поляризации при адсорбции поверхностно активных веществ происходит в результате либо резкого сокращения активной поверхности катода и обусловленного этим местного возрастания плотности тока, либо увеличения энергии активации, необходимой для проникновения катионов через адсорбционный слой к поверхности катода. [15]
Страницы: 1 2 3