Адсорбция - поверхностно-активное вещество
Cтраница 4
Во-первых, при адсорбции поверхностно-активного вещества часть поверхности электрода оказывается блокированной. На занятых органическим веществом участках электрохимическая реакция не протекает или протекает лишь с небольшой скоростью. [46]
Во-вторых, при адсорбции поверхностно-активных веществ изменяется заряд поверхности при данном потенциале, а следовательно, изменяется и - потенциал. [47]
Во-первых, при адсорбции поверхностно-активного вещества часть поверхности электрода оказывается блокированной. На занятых органическим веществом участках электрохимическая реакция не протекает или протекает лишь с небольшой скоростью. [48]
Во-вторых, при адсорбции поверхностно-активных веществ изменяется заряд поверхности при данном потенциале, а следовательно, изменяется и - потенциал. [49]
Известно, что адсорбция поверхностно-активных веществ ( ПАВ) на межфазной поверхности приводит к образованию на поверхности ориентированного монослоя, снижающего поверхностное натяжение. Углеводороды практически нерастворимы в воде, а вода является высокополярной жидкостью. На рис. 17.3 показано, как молекулы идеального ПАВ адсорбируются на поверхности воды. Полярные головки молекул проникают в воду, а углеводородные хвосты остаются в газовой фазе. Для образования монослоя требуется относительно немного молекул. [50]
Согласно [65], адсорбция поверхностно-активных веществ на данной твердой поверхности всегда вызывает улучшение избирательного смачивания той жидкостью, из которой адсорбция происходит. Следовательно, введение в водную среду системы углеводород - кислый электролит водорастворимых ингибиторов будет способствовать гидрофилизации поверхности металла с образованием на нем тонкого слоя электролита, в котором в присутствии сероводорода развивается интенсивный процесс коррозии. [51]
Изменение же скорости адсорбции поверхностно-активных веществ при изменении концентрации электролита не укладывается в представлении об изменении поверхностной активности органической добавки, поскольку при увеличении высаливающего действия электролита происходит не ускорение адсорбции, как это следовало бы ожидать, а замедление. [52]
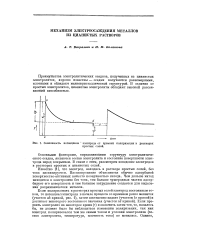 |
Зависимость потенциала электрода от времени поляризации в растворах. [53] |
Пассивирование объясняется обычно адсорбцией поверхностно-активных веществ поверхностью катода. Чем дольше катод находится в электролите без тока, тем больше чужеродных частиц адсорбирует его поверхность и тем большее затруднение создается для выделения разряжающегося металла. [54]
Зная, как протекает адсорбция поверхностно-активных веществ хотя бы на одном из металлов, например на ртути, можно, используя предложенную Л. И. Антроповым [6], приведенную или ф-шка-лу, найти наиболее вероятную область потенциалов, в которой следует ожидать адсорбцию тех же самых веществ на поверхности любого другого металла. [55]
Значительно большее представление об адсорбции поверхностно-активных веществ при электроосаждении металла может дать изменение катодных потенциалов во времени при какой-либо постоянной плотности тока, наблюдаемое в первые секунды электролиза. На этом принципе авторами был разработан электрохимический метод изучения скорости адсорбции, который позволил, с одной стороны, изучить скорость адсорбции некоторых поверхностно-активных веществ на поверхности твердого электрода в процессе электроосаждения металла и, с другой - выявить некоторую взаимосвязь между скоростью адсорбции поверхностно-активного вещества и характером электролитического осадка на катоде. [56]
Адсорбционный потенциал возникает при адсорбции поверхностно-активных веществ или ионов. [58]
Во всяком случае, адсорбция поверхностно-активных веществ может повышать электрохимическую энергию активации процесса растворения железа благодаря блокировке более легких путей реакций. Это обстоятельство, а также простое уменьшение свободной активной поверхности вследствие ее заполнения являются главными причинами перенапряжения, наблюдающегося при ингибиро-вании коррозии железа. [59]
Зная, как протекает адсорбция поверхностно-активных веществ хотя бы на одном из металлов, например на ртути, можно, используя предложенную Л. И. Антроповым [6], приведенную или ф-шка-лу, найти наиболее вероятную область потенциалов, в которой следует ожидать адсорбцию тех же самых веществ на поверхности любого другого металла. [60]
Страницы: 1 2 3 4 5
