Адсорбция - слабый электролит
Cтраница 1
Адсорбция слабых электролитов ( например, органических кислот) большей частью не обнаруживает различий по сравнению с неэлектролитами. Растворенное вещество адсорбируется в виде молекул, поэтому этот процесс называют молекулярной адсорбцией. Адсорбция сильных электролитов сопровождается рядом новых явлений, связанных с зарядами свободных ионов. Наряду с эквивалентной адсорбцией обоих ионов в одинаковом количестве, наблюдаются специфические различия в адсорбируе-мости ионов. Одним из проявлений этой специфичности является обменная адсорбция. [1]
Адсорбция слабых электролитов не обнаруживает особых отличий по сравнению с адсорбцией неэлектролитов - в обоих случаях растворенное вещество адсорбируется в виде молекул. Поэтому такой процесс называется молекулярной адсорбцией. [2]
При адсорбции слабых электролитов ( например, органических кислот) не обнаруживается различий по сравнению с неэлектролитами. Растворенное вещество адсорбируется в виде молекул, поэтому этот процесс называется молекулярной адсорбцией. При наличии сильных электролитов наблюдается обменная адсорбция, сущность которой состоит в том, что адсорбент поглощает из раствора ионы одного знака - катионы или анионы. Для сохранения электронейтральности поглощение сопровождается переходом из адсорбента в раствор эквивалентного количества других ионов того же знака. [3]
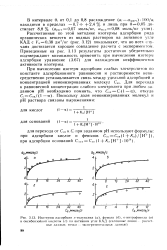 |
Изотермы адсорбции.. - толуидина ( о, фенола ( б, н-нитрофенола ( в и оксибен. чойиой кислоты ( с на активном угле КАД ( сплошные линии расчетные данные, точки - экспериментальные данные. [4] |
При вычислении изотерм адсорбции слабых электролитов по константе адсорбционного равновесия и растворимости непосредственно устанавливается связь между удельной адсорбцией и концентрацией неионизированных молекул Снн. [5]
Следовательно, на величину адсорбции слабых электролитов рН растворов влияет постольку, поскольку от него зависит степень электролитической диссоциации молекул веществ в растворе. [6]
Во второй характерной точке изотермы адсорбции слабых электролитов ( при aH2o / 2 равном возможному числу Н - связей молекулы с водой или минимальному числу гидратации) величина / OH о / / н2о также может быть найдена. [7]
Реакция среды оказывает заметное влияние на адсорбцию слабых электролитов, так как адсорбция в общем случае протекает молекулярно. [8]
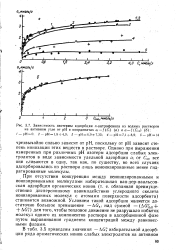 |
Зависимость изотермы адсорбции - нитрофенола из водных растворов. [9] |
Однако при выражений измеренных при различных рН изотерм адсорбции слабых электролитов в виде зависимости удельной адсорбции а, от Сни все они сливаются в одну, так как, по существу, во всех случаях адсорбировались из раствора лишь неионизированные менее гид-ратированные молекулы. [10]
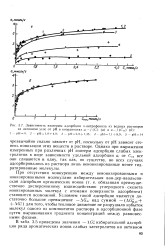 |
Зависимость изотермы адсорбции - нитрофенола из водных растворов. [11] |
Однако при выражении измеренных при различных рН изотерм адсорбции слабых электролитов в виде зависимости удельной адсорбции а, от С все они сливаются в одну, так как, по существу, во всех случаях адсорбировались из раствора лишь неионизированные менее гид-ратированные молекулы. [12]
Основными факторами, влияющими на адсорбцию органических веществ, обладающих свойствами слабых Электролитов, являются рН их растворов, структура молекул и характер функциональных групп. Качественная зависимость адсорбции слабых электролитов от их диссоциации была установлена еще Френндлихом, а затем неоднократно подтверждена в дальнейшем рядом исследователей. [13]
При распределении имеет значение сетчатость ( поперечная связанность) матрицы ионообменника: большие молекулы не могут проникнуть через узкие поры и поэтому не поглощаются сильносшитыми ионообменниками или сорбция их очень мала. Закономерности адсорбции сильных электролитов иные, так как при этом действуют электростатические силы, которые не играют роли при адсорбции слабых электролитов и неэлектролитов. [14]
Страницы: 1