Адсорбция - двуокись - сера
Cтраница 1
Адсорбция двуокиси серы на цеолите NaY приводит к появлению полос в области 1330 и 2470 см-1, приписываемых физически адсорбированному газу. При нагревании до 400 С изменений в спектре не наблюдается. [1]
Если лимитирующим этапом является адсорбция двуокиси серы, скорость прямой реакции пропорциональна парциальному давлению двуокиси серы в первой степени, а скорость обратной реакции от него не зависит. [2]
Первой стадией каталитического процесса является адсорбция двуокиси серы на поверхности пятиокиси ванадия. [3]
Другой метод очистки дымовых газов заключается в адсорбции двуокиси серы активированным углем или силикагелем. Во время адсорбции углем часть двуокиси всегда окисляется в трехокись; затем во время десорбции она восстанавливается углем в двуокись. Выделенная двуокись частично смешана с двуокисью углерода. Поскольку в процессе имеются потери угля, надо применять дешевый активированный уголь. [4]
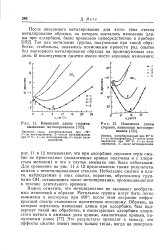 |
Изменения длины стержня, вызванные метилированием. [5] |
И и 12 показывают, что при адсорбции двуокиси серы сжатие не происходило ( аналогичные кривые получены и с хлористым метилом) и что в случае аммиака оно было небольшим. Для сравнения на рис. И и 12 представлены также результаты опытов с неметилированным стеклом. Небольшие сжатия и плато, наблюдаемые в этих опытах, вероятно, обусловлены группами ОН, оставшимися после метилирования, производившегося в течение длительного времени. [6]
Рассмотрим в качестве примера случай, когда наиболее медленной стадией процесса является адсорбция двуокиси серы на поверхности катализатора, покрытой кислородом. [7]
Предположим, что адсорбция кислорода велика, адсорбция трехокиси серы мала, а адсорбция двуокиси серы осуществляется со средней силой и подчиняется закономерностям адсорбции на равномерно неоднородной поверхности. [8]
Предположим, что адсорбция кислорода велика, адсорбция трехокиси серы мала, а адсорбция двуокиси серы осуществляется со средней силой и подчиняется закономерностям адсорбции на равномерно неоднородной поверхности. [9]
Значение предэкспоненциального множителя в выражении для константы скорости реакции можно оценить теоретически с помощью метода переходного состояния, исходя из предположения, что лимитирующим этапом является адсорбция двуокиси серы на поверхности платины, покрытой кислородом. Расчет дает величину примерное 10 раз меньше экспериментальной. [10]
Значение предэкспоненциального множителя в выражении для константы скорости реакции можно оценить теоретически с помощью метода переходного состояния, исходя из предположения, что лимитирующим этапом является адсорбция двуокиси серы на поверхности платины, покрытой кислородом. Расчет дает величину примерно в 10 раз меньше экспериментальной. [11]
Это кинетическое уравнение логически вытекает из определенных представлений о механизме контактного окисления двуокиси серы на платине, а именно из предположения, что лимитирующим этапом процесса является адсорбция двуокиси серы на поверхности платины, покрытой кислородом. Возможно, что эта адсорбция непосредственно приводит к образованию на поверхности катализатора трехокиси серы. Остальные этапы - отщепление трехокиси серы и адсорбция кислорода-осуществляются настолько быстро, что концентрация адсорбированных молекул двуокиси серы на поверхности оказывается близкой к равновесной по отнсшэнию к концентрации трехокиси серы и кислорода в газовой фазе. Замедляющее влияние трехокиси серы на скорость прямой реакции объясняется увеличением доли поверхности, занятой двуокисью серы, с ростом концентрации трехокиси серы в газовой фазе. Скорости образования и разложения трехокиси серы рассматриваются как разности скоростей прямой и обратной реакции. [12]
Это кинетическое уравнение логически вытекает1 из определен-1 ных представлений о механизме контактного окисления двуокиси серы на платине, а именно из предположения, что лимитирующим этапом процесса является адсорбция двуокиси серы на поверхности платины, покрытой кислородом. Возможно, что эта адсорбция непосредственно приводит к образованию на поверхности катализатора трехокиси серы. Остальные этапы - отщепление трехокиси серы и адсорбция кислорода-осуществляются настолько быстро, что концентрация адсорбированных молекул двуокиси серы на поверхности оказывается близкой к равновесной по отношению к концентрации трехокиси серы и кислорода в газовой фазе. Замедляющее влияние трехокиси серы на скорость прямой реакции объясняется увеличением доли поверхности, занятой двуокисью серы, с ростом концентрации трехокиси серы в газовой фазе. Скорости образования и разложения трехокиси серы рассматриваются как разности скоростей прямой и обратной реакции. [13]
Не исключено, впрочем, что это уравнение отвечает переходным условиям между случаями, когда каталитический процесс лимитируется адсорбцией кислорода и адсорбцией двуокиси серы. [14]
Из экспериментальных данных бесспорно следует, что скорость прямой реакции замедляется с увеличением концентрации трехокиси серы. Зто заставляет считать, что четвертый этап не может быть лимитирующим, так как в этом случае скорость прямой реакции не зависела бы от концентрации трехокиси серы. Из кинетических уравнений, выведенных для оставшихся трех случаев, в наилучшем соответствии с экспериментальными данными находится кинетическое уравнение, выведенное из предположения, что лимитирующим этапом является адсорбция двуокиси серы [ уравнение ( I, 40), стр. [15]
Страницы: 1 2