Возможность - разрыв - связь
Cтраница 1
Возможность разрыва связи зависит эт ее поляризуемости. Поляризуемостью связи называется ее способность становиться полярной ( или более полярной) в результате действия на молекулу внешнего электрического поля. [1]
Для работы в наладочном режиме электросхемой предусмотрена возможность разрыва связи автомата с прессом. Автомат контролирует 35 заготовок в 1 мин, что несколько превышает производительность пресса. [2]
Термическая устойчивость органических соединений в отсутствие термоокислительной деструкции определяется возможностью разрыва связей С - С, С-О, С-N, С - Н и других связей при высоких температурах. Высокой стабильностью в этих условиях обладают многоядерные ароматические углеводороды. [3]
Авторы объясняют это, с одной стороны, стерическими затруднениями, которые сказывают 7 тРиФт РпРопильные радикалы образованию сшитых структур, а с другой стороны, возможностью разрыва связей Si-С в результате перехода атома фтора из 7-положения в заместителе к атому кремния. Отрицательное влияние на термическую стабильность пслиорганосилоксанов феннльных радикалов с большим содержанием хлора может быть объяснено [13-17] ослаблением связи С-С), что приводит к образованию при высоких температурах повышенных количеств хлористого водорода, способствующего разрушению полимера. [4]
Следствием этого является возможность разрыва связи между атомами азота и разрушения гидразинной группировки в сравнительно мягких условиях. С другой стороны, если при некоторых реакциях или электронном ударе возникает дефицит внешних электронов у одного из атомов азота, то присутствие соседней неподеленной пары электронов открывает возможность упрочнения связи азот - азот и появления таких характерных для химии гидразинов реакционноспособных частиц, как аминонит-рены, диазениевые катионы и ион-радикалы, не склонные к фрагментации по этой связи. [5]
Механизм расщепления связи С - Г подробно рассматривается в статье Л. Г. Феоктистова ( стр. Здесь можно лишь указать, что В. П. Петровым и Г. Г. Якобсоном [12] на примере о-дифторбензо-ла, по-видимому, впервые показана возможность разрыва связи С-F на ртутном капельном электроде у ароматического цикла при потенциале от - 2 62 до - 2 68 в в среде диметилформамида. [6]
Следует также напомнить, что при понижении давления ниже известного предела константы скорости мономолекулярной реакции начинают уменьшаться. Это связано с изменением порядка реакции от первого ко второму. Указанное изменение порядка реакции обусловлено тем, что активированные молекулы распадаются лишь через некоторое время после их активирования; это время необходимо для такого перераспределения энергии между связями, которое создало бы возможность разрыва связи. Если время существования активированных молекул мало по сравнению со временем между соударениями, то большая часть их успеет распасться. Это может произойти лшль при очень низких давлениях. [7]
Следует также напомнить, что при понижении давления ниже известного предела константы скорости мономолекулярной реакции начинают уменьшаться. Это связано с изменением порядка реакции от первого ко второму. Указанное изменение порядка реакции обусловлено тем, что активированные молекулы распадаются лишь через некоторое время после их активирования; это время необходимо для такого перераспределения энергии между связями, которое создало бы возможность разрыва связи. Если время существования активированной молекулы мало по сравнению со временем между соударениями, то большая часть их успеет распасться. Это может произойти лишь при очень низких давлениях. При обычных же и повышенных давлениях большая часть активированных молекул дезактивируется при последующих столкновениях д доля их остается постоянной; в соответствии с этим реакция протекает по первому порядку. [8]
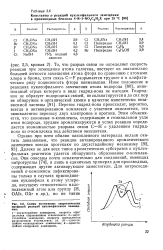 |
Схемы возможных энергетических профилей реакций нуклеофильного замещения. [9] |
То, что разрыв связи не определяет скорость реакции при замещении атома галогена, явствует из значительно большей легкости замещения атома фтора по сравнению с атомами хлора и брома, хотя связь С-F разрывается труднее и в алифатическом ряду подвижность фтора наименьшая. Иное положение в реакциях нуклеофильного замещения атома водорода [80], анио-ноидный отрыв которого в виде гидрид-иона не выгоден. Перенос гидрид-иона происходит, вероятно, всегда в активированном комплексе с участием окислителя, что эквивалентно переносу двух электронов и протона. Этим объясняется, что анионные ст-комплексы, содержащие в геминальном узле атом водорода, труднее ароматизируются и успех реакции определяется возможностью разрыва связи С - Н с удалением гидрид-иона из о-комплекса под действием окислителя. [10]
В специальном исследовании реакций перекиси водорода с различными ионами галогенов Эдварде [13] обобщил большое количество кинетических измерений и показал, что они согласуются с теориями общего кислотного катализа. Автор при этом не защищает никакого определенного механизма, по указывает, что наблюдавшиеся явления согласуются с тем, что мы здесь называем механизмом с ионом гидроксила. В этой работе [65] показано, что кинетический закон для механизма с ионом гидроксила в то же время согласуется и с таким механизмом, при котором отсутствует разрыв связи О-О. В этот класс входят различные примеры окисления перекиси водорода; например, опыты с изотопом кислорода в качестве меченого атома, проведенные Кахнлом и Таубе [46], показывают, что кислород, выделяющийся при реакции с гипохлоритом ( в одном из примеров Эдвардса), получается исключительно из молекулы перекиси водорода, а поэтому возможность разрыва связи О-О исключается. Бантон и Левеллин [66] считают, что механизм радикального иона гидроксила для случая разложения перекиси водорода в растворе хлорной кислоты невероятен, однако они не сообщают о подробностях своей работы с мечеными атомами и о предложенных итоговых реакциях. По мнению Магдэна и Юнга [67], некоторые реакции гидроксилировапия перекиси водорода, которые, по имеющимся данным, катализируются определенными металлами, протекают по механизму с попом гидроксила, но через образование пероксокислот. [11]
Страницы: 1