Отрицательная адсорбция
Cтраница 1
Отрицательная адсорбция - довольно неопределенное выражение, относящееся к такому явлению, когда в суспензии, образуемой частицами адсорбента в растворе, один из компонентов раствора оказывается сконцентрированным в большей степени, а второй компонент, наоборот, в меньшей степени вблизи поверхности адсорбента на расстоянии одного-двух молекулярных диаметров по сравнению с концентрациями компонентов в объеме жидкости. [1]
Отрицательная адсорбция может быть вызвана или втягиванием сильно сольватированных частиц с поверхности в объем раствора, или отталкиванием ионов от одноименно заряженной поверхности электрода. Первый эффект приводит к заметной отрицательной адсорбции только в концентрированных растворах ( 1 моль / л), в то время как отталкивание ионов от одноименно заряженной поверхности электрода вызывает существенную отрицательную адсорбцию и в разбавленных растворах. [2]
Отрицательная адсорбция встречается редко. Отрицательная адсорбция имеет место в том случае, когда растворитель ( для подвергающегося адсорбции вещества) сам адсорбируется в значительной мере. После того как закончен процесс отрицательной адсорбции, концентрация раствора, из которого происходит адсорбция, повышается вследствие того, что происходит адсорбция растворителя. Типичные примеры отрицательной адсорбции встречаются в гелях или вообще в сольватированных коллоидах, для которых адсорбция растворителя играет важную роль. [3]
Отрицательная адсорбция ионов, диффузия которых с поверхности в объем раствора может быть осложнена вследствие возникновения двойного электрического слоя диполей, и образование ионного двойного электрического слоя. [4]
 |
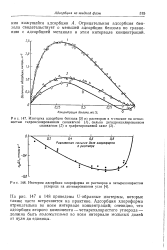
Зависимость адсорбции катионов ( 1 и анионов ( 2 от потенциала электрода в 0 1 н. растворе поверхностно-неактивного электролита. [5] |
Отрицательная адсорбция анионов и катионов выражается заштрихованной площадью. В разбавленных растворах поверхностно-неактивных электролитов ( ступенчатая линия 2) отрицательная адсорбция соли мала и ее обычно не удается экспериментально обнаружить. [6]
Отрицательная адсорбция бензола свидетельствует о меньшей адсорбции бензола по сравнению с адсорбцией метанола в этом интервале концентраций. [8]
Отрицательная адсорбция соли объясняется сольватацией ионов, в результате которой между электродом и ионами оказывается слой молекул растворителя. Отрицательная адсорбция анионов и катионов выражается заштрихованной площадью. В разбавленных растворах поверхностно-неактивных электролитов ( ступенчатая линия 2) отрицательная адсорбция соли мала, и ее обычно не удается экспериментально обнаружить. [10]
 |
Зависимость адсорбции катионов ( 1 и анионов ( 2 от потенциала электрода в 0 1 н. растворе поверхностно-неактивного электролита. [11] |
Отрицательная адсорбция анионов и катионов выражается заштрихованной площадью. В разбавленных растворах поверхностно-неактивных электролитов ( ступенчатая линия 2) отрицательная адсорбция соли мала и ее обычно не удается экспериментально обнаружить. [12]
Отрицательную адсорбцию можно истолковать только таким образом, что растворитель адсорбируется сильнее, чем растворенное вещество и при этом повышается его молекулярная концентрация относительно исходного раствора. В системах неограниченно смешивающихся жидкостей, для которых можно рассматривать весь интервал концентраций, между растворителем и растворенным веществом отсутствует какое бы то ни было различие. По этой причине применение уравнения ( 2) к изотермам S-образного типа лишено смысла. [13]
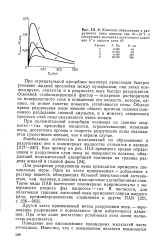 |
Кинетика образования и разрушения пены вискозы при 18 - 20 С и следующих значениях остаточного давления Р и высоты слоя Н. [14] |
При отрицательной адсорбции полимера происходит быстрое утонение жидкой прослойки между пузырьками, они легко коа-лесцируют, лопаются и в результате пена быстро разрушается. Основной стабилизирующий фактор - испарение растворителя из поверхностного слоя и повышение его вязкости, которое, однако, не может заметно повысить устойчивости пены. Обычно время разрушения пены меньше общего времени седиментаци-онного разделения газовой эмульсии, и к моменту завершения процесса слой пены оказывается очень тонким. [15]
Страницы: 1 2 3 4 5