Возникновение - смешанный потенциал
Cтраница 1
Возникновение смешанного потенциала часто служит источником заметных ошибок при определении кинетических параметров объемных реакций. Наиболее вероятна причина расхождения - несостоятельность предположения, что в смеси двух систем Вг2 - Вг -, Т13 - Т1 потенциал платинового электрода контролируется только бром - бромидной парой. [1]
Высокое перенапряжение водорода на ртути предотвращает возникновение смешанного потенциала, получающегося при выделении водорода. [2]
Итак, в тех случаях, когда возможно возникновение смешанных потенциалов ( г1), необходимо экспериментально проверить соответствие вычисленных потенциалов фактическим. [3]
Кроме термодинамической необратимости причиной, вызывающей несовпадение вычисленного и измеренного значений потенциала, может быть также возникновение смешанных потенциалов. Переход тогда может осуществляться ступенчато, что равноценно одновременному присутствию нескольких редок-сипар. Измеряемый потенциал обусловливается наличием всех этих редоксипар и не может быть вычислен применением уравнения Нернста к одной из этих пар. Вследствие этого потенциал в таких случаях называют смешанным. [4]
Кроме термодинамической необратимости причиной, вызывающей несовпадение вычисленного и измеренного значений потенциала, может быть также возникновение смешанных потенциалов. [5]
Поэтому важно уяснить, что измерения с помощью электрода с низким водородным сверхпотенциалом дают погрешность, обусловленную возникновением смешанного потенциала. Грубе и Шлехт [89] применяли электрод из электролитически полученного олова; значения реального потенциала равны - 0 411 В в 0 0015 М серной кислоте и от - 0 386 до - 0 373 В в 0 1 М серной кислоте. [6]
Поэтому важно уяснить, что измерения при помощи электрода с низким водородным сверхпотенциалом дают ошибку в связи с возникновением смешанного потенциала. Грубе и Шлехт41, проводившие систематическое изучение пары Сг111 - Сг11, применяли электрод из электролитически полученного олова, так как платиновый электрод дает ошибочные результаты. До них Форбе и Рихтер42 и затем Лингейн43 применяли ртутный электрод, но они предпочли оловянный. [7]
Нернста не выполняется, так как МпОГ и Мп2 проявляют тенденцию к взаимодействию с образованием МпО2, что приводит к возникновению смешанного потенциала. Предположим, однако, что это взаимодействие протекает настолько медленно, что им можно пренебречь. И даже тогда уравнение Нернста не выполняется, если не обеспечить протекание реак-ции в соответствии с уравнением в обоих направлениях. Следует отметить, что стандартные потенциалы обеих пар ( Mnvn - Мп11 и Мпш - Мп11) выше теоретического потенциала разложения воды. Потенциал перманга-ната, по-видимому, является смешанным потенциалом, возникающим в результате компенсации катодного тока реакции восстановления перманганата анодным током реакции окисления воды. При повышении концентрации перманганата потенциал становится более положительным в результате увеличения катодного тока. Действие, которое оказывают ионы марганца ( II) в отсутствие комплексантов, стабилизирующих Мпш, выражается в понижении устойчивости ионов перманганата. [8]
Нернста не выполняется, так как MnOJ и Мп2 проявляют тенденцию к взаимодействию с образованием МпО2, что приводит к возникновению смешанного потенциала. Предположим, что это взаимодействие протекает настолько медленно, что им можно пренебречь. Но даже тогда уравнение Нернста не выполняется, если не обеспечить протекание реакции в соответствии с уравнением в обоих направлениях. В рассматриваемом случае механизм обеих полуреакций довольно сложен. [9]
В то же время нельзя забывать, что при существенном расходе обратимой ОВС и накоплении продуктов окислительно-восстановительной реакции, с0х QX, на индикаторном электроде возможно возникновение смешанных потенциалов или даже нестационарности измерений ЭДС. [10]
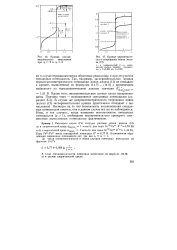 |
Кривая оксиди-метрического титрования при 2i 2 и г2 5.| Кривые цериметриче-ского титрования ионов железа ( II. [11] |
Кроме того, экспериментальные данные плохо воспроизводимы. В случае же дихроматометрического титрования ионов железа ( II) экспериментальная кривая практически совпадает с вычисленной. Несмотря на то что возможность возникновения смешанных потенциалов имеется, они в данном случае все же не наблюдаются. Итак, в тех случаях, когда возможно возникновение смешанных потенциалов ( z 1), необходимо экспериментально проверить соответствие вычисленных потенциалов фактическим. [12]
Казалось бы, что непосредственное измерение потенциала электрода ( аналогично измерению рН) можно легко использовать для определения рМ в процессе титрования ЭДТА. К сожалению, многие металлические электроды не являются обратимыми, особенно при крайне низких концентрациях соответствующих ионов металлов вблизи конечной точки титрования с помощью ЭДТА. Определению рМ часто мешают не только малые плотности тока обмена ( для переходных металлов обратимость не наблюдается даже при сравнительно высоких концентрациях ионов металлов), но также побочные электродные реакции, приводящие к возникновению смешанного потенциала ( см. разд. Это особенно относится к растворам наиболее активных ионов металлов с очень низкими концентрациями; в этом случае металлы имеют высокие восстановительные потенциалы, и определение затрудняется. В частности, мешающее действие часто оказывает выделение водорода. Вместе с тем значение рМ металлов, для которых разработаны ионоселективные электроды, можно определить измерением потенциала мембраны. [13]
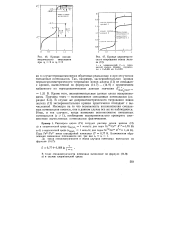 |
Кривая оксиди-метрического титрования при 2i 2 и г2 5.| Кривые цериметриче-ского титрования ионов железа ( II. [14] |
Кроме того, экспериментальные данные плохо воспроизводимы. В случае же дихроматометрического титрования ионов железа ( II) экспериментальная кривая практически совпадает с вычисленной. Несмотря на то что возможность возникновения смешанных потенциалов имеется, они в данном случае все же не наблюдаются. Итак, в тех случаях, когда возможно возникновение смешанных потенциалов ( z 1), необходимо экспериментально проверить соответствие вычисленных потенциалов фактическим. [15]
Страницы: 1