Возникновение - коррозионный элемент
Cтраница 2
Развитие щелевой коррозии связывают с затруднением доступа кислорода из объема электролита в зазор, изменением рН раствора электролита в зазоре и возникновением коррозионного элемента типа щель - открытая поверхность. Затруднение доступа кислорода вызывает торможение катодного процесса, в результате чего электродный потенциал металла в зазоре понижается и облегчается протекание анодного процесса. [16]
Если в начале развития электрохимической теории основную причину электрохимической гетерогенности видели в загрязнении основного металла электрохимически положительными примесями, то, по современным воззрениям, возникновение коррозионных элементов на поверхности металла может вызываться и многими другими причинами. [17]
Если в начале развития электрохимической теории видели основную причину электрохимической гетерогенности в наличии загрязнений основного металла электрохимически положительными примесями, то, по современным воззрениям, возникновение коррозионных элементов на поверхности металла может вызываться кроме этой причины многими другими. [18]
Таким образом, влияние биологического фактора на коррозионный процесс может проявляться как в виде непосредственного воздействия на металл продуктов, вырабатываемых микроорганизмами ( сероводород), так и в виде образования на металле пленок, способствующих возникновению коррозионных элементов дифференциальной аэрации. [19]
На практике чаще всего приходится иметь дело с элементами третьего типа. Возникновение коррозионных элементов происходит не только при контакте разнородных металлов, но и при воздействии электролита на один и тот же металл, отличающийся на различных участках физической или химической неоднородностью. [20]
С точки зрения электрохимической теории металлов действие замедлителей может быть объяснено следующим образом. Для возникновения коррозионного элемента, как известно, необходимо наличие трех факторов: разности потенциалов между двумя отдельными участками металла, проводимости создавшейся электрической цепи и возможности протекания электродной реакции на границе металл - раствор. [21]
 |
Схема движения тока в коррозионных элементах различного размера. [22] |
Так, при возникновении коррозионного элемента между ока-линой, расположенной на поверхности трубы, и основным металлом трубопровода разность потенциалов может достигать 0 45 в. Красная ржавчина, образующая на поверхности трубы корку, и основной металл создают коррозионный элемент с разностью потенциалов около 0 65 в. Во всех случаях металл служит анодом возникающего элемента и вследствие этого подвергается разрушению. Поэтому, например, при контакте двух трубопроводов разного возраста более старый, покрытый продуктами коррозии, будет играть роль катода, а новый - анода. [23]
На металлической поверхности трубопровода могут возникать катодные и анодные участки при наличии какой-либо неоднородности электрохимического потенциала поверхности. Эта неоднородность является причиной возникновения коррозионных элементов ( коррозионных пар), приводящих к местному разрушению металлической поверхности. [24]
Неравномерный доступ кислорода к верхней и нижней частям трубы ( рис. 10, а) приводит к образованию макроэлемента, действующего по окружности газопровода. С увеличением диаметра газопровода опасность возникновения коррозионного элемента этого типа возрастает. [25]
Коррозия может начаться в конструкциях, в которых возможен застой и накапливание жидкости в пазах и углублениях, а также образование неравномерного слоя осадка на стенках аппаратов. В этом случае создаются условия для возникновения коррозионных элементов и протекания процесса коррозии. [26]
Таким образом, влияние биологического фактора на коррозионный процесс может проявляться как путем непосредственного действия на металл продуктов, вырабатываемых микроорганизмами, так и путем облегчения деполяризации. Некоторые бактерии образуют на металле пленки, которые способствуют возникновению коррозионных элементов дифференциальной аэрации. [27]
Некоторые бактерии могут оказывать косвенное влияние на протекание коррозионного процесса. Эти бактерии образуют на поверхности металла, смоченной водой, микробиологическую пленку, которая способствует возникновению коррозионных элементов. Биокоррозия может проявляться как путем непосредственного воздействия на металл выделяемых микроорганизмами продуктов, так и путем облегчения процесса деполяризации. [28]
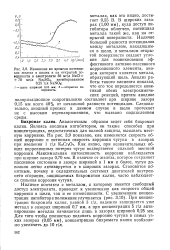 |
Изменение во времени потенциала железа в щелях и на открытой поверхности в электролите 30 мг / л NaCl 70 мг / л Na2S04, ингибированном 0 25 г / л NaN02. [29] |
В широких зазорах ( 1 00 мм), куда доступ ингибитора облегчен, потенциал металла такой же, как на открытой поверхности. Наличие большой разности потенциалов между металлом, находящимся в щели, и металлом открытой поверхности создает условия для возникновения эффективного активно-пассивного коррозионного элемента, анодом которого является металл, образующий щель. Анализ работы такого элемента показал, что его ток определяется кинетикой обеих электрохимических реакций, причем анодное поляризационное сопротивление составляет при ширине зазора 0.15 мм всего 40 % от начальной разности потенциалов. Следовательно, анодный процесс в данном случае в щели протекает не с высоким перенапряжением, что вызвано подкислением среды. [30]
Страницы: 1 2 3