Возрастание - подвижность
Cтраница 1
Возрастание подвижности при введении алкильных и ариль-ных групп, повидимому, наблюдается во всех случаях. Примером этому служит возрастание подвижности с увеличением длины углеродной цепи в гомологических рядах, на чем и основано разделение членов данного ряда. Уменьшение подвижности при введении полярных групп также является весьма общим правилом, что видно на примере введения в молекулу гидроксильной группы, аминогруппы и др. Одновременное удлинение углеродной цепи и введение гидроксильных групп уменьшает подвижность. При наличии нескольких полярных групп подвижность соединения зависит также от их взаимного расположения. [1]
Возрастание подвижности при росте Е / р не находит себе объяснения в рамках теории, учитывающей взаимодействие ионов и молекул только в форме упругих столкновений. [2]
Возрастание подвижности электронов до и после концентрационного минимума электропроводности указывает па возможность туннелирования между ловушками; во всяком случае, лучшего объяснения пока найти не удалось. Крайне важно развить для данного явления полную кинетическую теорию; сейчас высказаны различные догадки о характере влияния молекулярного движения в растворителе. [3]
Возрастание подвижности электронов до и после концентрационного минимума электропроводности указывает на возможность туннелирования между ловушками; во всяком случае, лучшего объяснения пока найти не удалось. Крайне важно развить для данного явления полную кинетическую теорию; сейчас высказаны различные догадки о характере влияния молекулярного движения в растворителе. [4]
Она характеризуется некоторым возрастанием подвижности в области температур обработки 1000 - 1800 С, резким увеличением в области 1800 - 2300 С и дальнейшим возрастанием подвижности в области температур обработки 2300 - 3000 С. [5]
 |
Формирование кинков на углеводородной цеп и вследствие со пряженных гош / гранс-иэомериэацин.| Влияние фазового перекода на упаковку молекул в бислое. [6] |
Таким образом, вследствие возрастания подвижности углеводородных цепей при температурах выше температуры фазового перехода липидный бислой становится менее упорядоченным и переводится из твердообразного геле-вого состояния в жидкоподобное, текучее состояние, в котором дальний порядок в расположении липидных молекул отсутствует, а углеводородные цепн совершают хаотические движения вокруг ординарных С-С - связей. [7]
Повышение температуры облучения эластомеров приводит к возрастанию подвижности их макромолекул, а также увеличению скорости диффузии содержащихся в них низкомолекулярных веществ. [8]
В этой таблице нефтедобывающие районы расположены в порядке возрастания средней подвижности нефти. Средние значения максимальных темпов и подвижности вычислены как средневзвешенные по отношению к начальным извлекаемым запасам нефти. [9]
В обоих названных случаях причиной уменьшения / служило, по-видимому, возрастание подвижности атомов в твердом теле в окрестности точек фазовых переходов. [10]
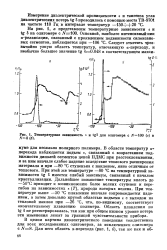 |
Температурная зависимость ь и tgS для олигомера с ЛГ100 ( а и. V8 ( б. [11] |
В области температур - перехода наблюдается подъем Е, связанный с возрастанием подвижности диполей сегментов цепей ПДМС при расстекловывании, и за ним вначале слабое падение вследствие теплового расширения материала и при - 80 С ступенька с наклоном, явно отличным от теплового. При этой же температуре - 80 С на температурной зависимости tg 8 имеется слабый максимум, связанный с началом кристаллизации. Дальнейшее повышение температуры вплоть до - 50 С приводит к возникновению более мелких ступенек и перегибов на зависимостях s ( Т), природа которых неясна. При температуре выше - 50 С плавление вначале сопровождается падением, а затем довольно крутой областью подъема s с выходом на тепловой наклон при - 26 С, что, по-видимому, соответствует окончательному плавлению полимера. [12]
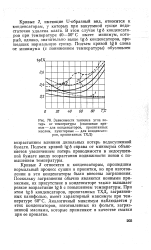 |
Зависимости тангенса угла потерь от температуры ( сплошные кривые - для конденсаторов, пропитанных маслом, пунктирные - для конденсаторов, пропитанных ТХД. [13] |
Подъем кривой tg6 справа от минимума объясняется увеличением потерь проводимости в недосушенной бумаге ввиду возрастания подвижности ионов с повышением температуры. [14]
Увеличение числа гидроксильных групп в молекулах двухатомных спиртов по сравнению с одноатомными спиртами приводит к возрастанию подвижности атомов водорода в гидроксилах, и поэтому гликоли обладают более кислыми свойствами, чем одноатомные спирты ( стр. Так, в отличие от одноатомных спиртов гликоли даже растворяют гидраты окислов тяжелых металлов. Например, при приливании этиленгликоля к голубому студенистому осадку гидрата окиси меди Си ( ОН) 2 образуется синий раствор гли-колята меди. Однако практически гликоли так же нейтральны, как одноатомные спирты, и не дают кислой реакции на лакмус. [15]
Страницы: 1 2 3 4 5