Прочная адсорбция - молекула
Cтраница 1
Прочная адсорбция молекулы О2 протекает с захватом электрона. [1]
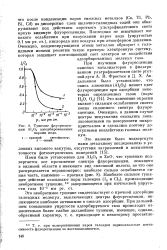 |
Тушение флуоресценции А12О3 адсорбированными парами иода. [2] |
Это необратимое тушение свидетельствует о прочной адсорбции галоидных молекул, выключающих центры флуоресценции, являющиеся наиболее активными в смысле адсорбции. [3]
Сильные кислотные центры алюмосиликатов могут локализовать реакцию за счет прочной адсорбции молекул, в результате чего крекинг заметно ускоряется по сравнению с переносом водорода. Прочное связывание с каталитическим центром может также промотировать образование конденсированных ароматических углеводородов и далее кокса. [4]
Из энергетической схемы каталитической реакции ( см. рис. 1) видно, что очень прочная адсорбция молекул на поверхности катализатора вследствие большого вклада теплоты адсорбции может увеличить энергию активации поверхностной реакции EAi net и в предельном случае воспрепятствовать реакции, Однако адсорбция необходима для активации молекул и протекания каталитической реакции. Следовательно, высокоактивна каталитическая система должна обладать оптимальной - не слишком сильной или слабой - адсорбционной способностью ( см. разд. [5]
Кроме того, при обычном простом рассмотрении вопроса нами не учитывается стабилизация возбуждаемой светом молекулы воздействием твердого тела, отводящим, как правило, избыточную колебательную энергию возбуждения, о чем говорилось выше. В результате прочной адсорбции молекулы на твердом теле такой отвод, энергии может оказаться преобладающим, и тогда фотораспад адсорбированной молекулы потребует поглощения большего кванта, чем это необходимо для газообразной молекулы. [6]
В спектрах адсорбированных пористым стеклом молекул воды также проявляется роль примесных атомов бора. В работе [32] считается, что прочная адсорбция молекул воды пористым стеклом при температурах ниже 300 С обусловлена взаимодействием адсорбированных молекул воды с двумя близкорасположенными гидроксильными группами. Уменьшение адсорбции при повышении температуры дегидроксилирования объясняется исчезновением на поверхности таких мест, наиболее выгодных для адсорбции молекул воды. Проведенные в этой работе гравиметрические адсорбционные измерения показали, что механизм прочной адсорбции молекул воды при более высоких температурах дегидроксилирования ( выше 600 С) другой. Авторы считают, что в этом случае адсорбция происходит на атомах бора поверхности пористого стекла и что это взаимодействие облегчает реакцию молекул воды с другими частями поверхности. [7]
Гораздо слабее, чем в спектре паров циклогексадиена при сравнимом поглощении у других частот, выражена полоса 1607 см-1, которая характеристична для валентных колебаний связей С С. Это позволяет высказать предположение, что при прочной адсорбции молекулы цик-логексадиена на палладии ослабляются или даже разрываются обе я-связи. [8]
Гораздо слабее, чем в спектре паров циклогексадиена при сравнимом поглощении у других частот, выражена полоса 1607 см-1, которая характеристична для валентных колебаний связей С С. Это позволяет высказать предположение, что при прочной адсорбции молекулы циклогексадиена на палладии ослабляются или даже разрываются обе л-связи. [9]
Большинство органических соединений, являющихся ингибиторами атмосферной коррозии, содержит в своем составе азот. Использование азотосодержащих соединений обусловлено присутствием в атоме азота необобщенной электронной пары, что обеспечивает более прочную адсорбцию азотосодержащей молекулы на металле. Однако существенным фактором адсорбции по атому азота является величина электронной плотности на атоме. Именно поэтому ароматические амины являются малоэффективными ингибиторами и практически не препятствуют атмосферной коррозии. [10]
Сидоров сделал вывод, что эти группы ( полоса при 3680 см 1; рис. 102), остающиеся на метилированном пористом стекле, не являются адсорбционными центрами молекул воды. Предполагалось, что такая прочная адсорбция молекул воды происходит на негидроксильных центрах, удаленных от гидроксильных групп настолько, что водородная связь с ними не образуется. [11]
В спектрах адсорбированных пористым стеклом молекул воды также проявляется роль примесных атомов бора. В работе [32] считается, что прочная адсорбция молекул воды пористым стеклом при температурах ниже 300 С обусловлена взаимодействием адсорбированных молекул воды с двумя близкорасположенными гидроксильными группами. Уменьшение адсорбции при повышении температуры дегидроксилирования объясняется исчезновением на поверхности таких мест, наиболее выгодных для адсорбции молекул воды. Проведенные в этой работе гравиметрические адсорбционные измерения показали, что механизм прочной адсорбции молекул воды при более высоких температурах дегидроксилирования ( выше 600 С) другой. Авторы считают, что в этом случае адсорбция происходит на атомах бора поверхности пористого стекла и что это взаимодействие облегчает реакцию молекул воды с другими частями поверхности. [12]
Поскольку возникающее поле не очень сильно и его напряженность весьма быстро падает с удалением от поверхности, то доля его участия в энергии адсорбции может быть значительной только в том случае, если полярная молекула обладает достаточно большим дипольным моментом и диполь расположен в молекуле таким образом, что он может приблизиться к поверхности на очень близкое расстояние. У водородсодержащих соединений, таких, как вода, аммиак, органические оксисоединения ( спирты, фенолы), органические амины и кислоты, диполи образованы водородными атомами функциональных групп и атомами, с которыми водородные атомы связаны. Во всех этих молекулах диполи находятся вблизи периферии молекул и, кроме того, они всегда направлены своими положительными концами к внешнему краю функциональных групп. В результате этого поверхности неорганических солей и окислов обладают сильно выраженной тенденцией к прочной адсорбции молекул воды [32], а также молекул органических спиртов, фенолов, аминов и кислот. Поверхности белковых веществ имеют внешние отрицательные заряды, связанные, например, с атомами кислорода групп СО, и поэтому периферические диполи могут адсорбироваться на них так же, как на поверхности неорганических веществ. Кроме того, поверхности углеводов и белков обладают собственными периферическими диполями ( группы ОН и NH), которые могут легко притягивать дипольные молекулы, в частности молекулы воды. [13]
Поскольку возникающее поле не очень сильно и его напряженность весьма быстро падает с удалением от поверхности, то доля его участия в энергии адсорбции может быть значительной только в том случае, если полярная молекула обладает достаточно большим дипольным моментом и диполь расположен в олекуле таким образом, что он может приблизиться к поверхности на очень близкое расстояние. У водородсодержащих соединений, таких, как вода, аммиак, органические оксисоединения ( спирты, фенолы), органические амины и кислоты, диполи образованы водородными атомами функциональных групп и атомами, с которыми водородные атомы связаны. Во всех этих молекулах диполи находятся вблизи периферии молекул и, кроме того, они всегда направлены своими положительными концами к внешнему краю функциональных групп. В результате этого поверхности неорганических солей и окислов обладают сильно выраженной тенденцией к прочной адсорбции молекул воды [32], а также молекул органических спиртов, фенолов, аминов и кислот. Поверхности белковых веществ имеют внешние отрицательные заряды, связанные, например, с атомами кислорода групп СО, и поэтому периферические диполи могут адсорбироваться на них так же, как на поверхности неорганических веществ. Кроме того, поверхности углеводов и белков обладают собственными периферическими диполями ( группы ОН и NH), которые могут легко притягивать дипольные молекулы, в частности молекулы воды. [14]
Известно, что жирные кислоты считаются наиболее эффективными присадками для снижения трения и износа. Они относятся к кислородсодержащим маслорастворимым ПАВ, занимающим первое: место по числу известных соединений, масштабам производства и распространения среди маслорастворимых ПАЗ. Особенно большую роль при проиаводстве маслорастворимых ПАВ играют жирные кислоты, получаемые из растительных жиров: стеариновая и 12-оксистеариновая кислоты. Высокая поверхностная активность их зависит от полярности группы ОН и наличия в карбоксильной группе поляризованной связи С-0, обеспечивающих более прочную адсорбцию молекул органических кислот на металле, что считается одним из условий создания стойких антифрикционных пленок, на поверхности металла. [15]
Страницы: 1 2