Волна - восстановление
Cтраница 1
Волна восстановления при том же потенциале имеется на ( ККЗ) нм электродов III и IV, однако ее длина сокращается по мере увеличения содержания осмия. На Os / Pt-электроде длина ( ККЗ) Нм фактически совпадает с ( ККЗ) Ф, что свидетельствует об отсутствии на нем хемосорбированного вещества. Как видно, способность нитрометана к адсорбции и хемосорбции определяется составом катализатора и оказывается наименьшей у осмия. [1]
Волна восстановления начинается при - 2 5 в. Высота пика тока при - 1 7 в также сильно зависит от скорости развертки напряжения, числа и частоты развертки и, по-видимому, в значительной степени контролируется диффузией мономера. [2]
Волна восстановления до фенилгидроксиламина пригодна для количественных определений. Однако в присутствии ПАВ ( желатин, камфара и т.п.) она может разделиться на две ступени вследствие эффекта адсорбции деполяризатора. При этом Е / 2 первой волны почти не изменяется, а второй - смещается к более отрицательным значениям. Суммарный ток обеих волн равен по высоте четы-рехэлектронной волне восстановления. Эту особенность поведения нитросоединений на РКЭ необходимо учитывать при выборе условий регистрации вольтамперограмм. [3]
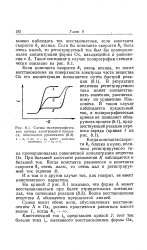 |
Схемы полярографических кривых электродного процесса, описанного уравнением. / - А. оо. 2 - ki имеет конечное значение. 3 - ki 0. [4] |
Волна восстановления вещества А обозначена прерывистой линией. [5]
Волна восстановления иона Ме должна наблюдаться при более положительных потенциалах, чем потенциалы восстановления Мел, и не должна проявляться, когда Мея и L содержатся в растворе в эквивалентных концентрациях. [6]
Волна восстановления Ge из водных растворов GeO2 появляется при рН 5; с уменьшением рН на нее накладывается волна разряда водородных ионов. Для подавления максимумов в раствор добавляют желатин. [7]
Волна восстановления трехвалентного кобальта до двухвалентного появляется при значительно более положительном потенциале, чем волна восстановления двухвалентного кобальта до металла. Величина потенциала полуволны лежит в пределах от 0 до - 0 5 в в зависимости от природы примененного адден-да. Это дает возможность определять кобальт в присутствии значительно большего количества посторонних элементов, чем при его восстановлении до металла. Для окисления кобальта до трехвалентного и его дальнейшего полярографирования предложены различные окислители и растворы различных основных электролитов. Рекомендовано также полярографировать трехвалентный кобальт в растворе сульфосалицилата натрия [1214] или цитрата натрия [1216] после окисления перекисью водорода; волна кобальта начинается почти при нулевом значении приложенного напряжения. Можно полярографировать кобальт в растворе комплексона III [1342], например после окисления с помощью двуокиси свинца [1123] в боратном буферном растворе при рН 8 - 9; в этом последнем случае определению не мешают медь, никель, марганец и цинк, хотя железо и хром должны быть удалены. [8]
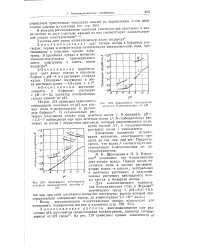 |
Зависимость потенциалов полуволн 8-оксихинолина от рН.| Зависимость потенциалов. [9] |
Волну восстановления 8-оксихинолина авторы используют для косвенного определения магния и алюминия ( стр. [10]
Вторая волна восстановления соответствует необратимому переносу электрона с параллельно-протекающей быстрой химической реакцией ( димеризацией кетильных радикалов), и ее форма подчиняется соответствующему уравнению Майрановского [3], особенно в средах с высоким содержанием спирта, где снижается искажающий картину эффект торможения адсорбированными на электроде димерами. [11]
Вторая волна восстановления соответствует необратимому переносу электрона с параллельнотфотекающей быстрой химической реакцией ( димеризацией кетильных радикалов), и ее форма подчиняется соответствующему уравнению Майрановского [3], особенно в средах с высоким содержанием спирта, где снижается искажающий картину эффект торможения адсорбированными на электроде димерами. [12]
Вторая волна восстановления нитробензола наблюдается при потенциале около - 1 9 В отн. Большое различие между реакциями в воде ( с образованием гидроксиламина или амина) и в ацетонитриле обусловлено низкой концентрацией протонов в ацетонитриле. Аллендерфер и Риджер [13] описали процесс восстановления как последовательность стадий протонирования после переноса каждого электрона. [13]
Вторая волна восстановления аниона СН3СОО - в ацетонитриле не появляется. Восстановление карбоксильной группы возможно в очень кислых электролитах. [14]
Вторая волна восстановления нитробензола совпадает с волной восстановления Л - фенилгидроксиламина ( о механизме восстановления последнего см. гл. Она появляется лишь в кислых средах и весьма чувствительна к условиям эксперимента и составу среды, поэтому не имеет существенного значения для аналитического определения и исследования реакционной способности ароматических нитросоединений. [15]
Страницы: 1 2 3 4