Дисс
Cтраница 1
ДИсс - тепло, затрачиваемое на диссоциацию. [1]
А дисс кислоты равна 1 86 - Ю-7. Из указанных данных следует, что ЦТМкарбоновая кислота по сравнению с бензойной и ферроценкарбоновой кислотами является более сильной, и ее константа диссоциации практически совпадает с константой диссоциации / г-хлорбензойной кислоты. [2]
Хотя А дисс и & рек не зависят от времени, функция распределения по состояниям молекулы АВ зависит от времени, стремясь к равновесной цо мере приближения реакции (12.38) к равновесию. [3]
Чем больше ДИСс, тем сильнее диссоциирован слабый электро-лит. Наряду с / Сдисс для количественной характеристики равновесия используют величину степени диссоциации а. Она характеризует долю молекул слабого электролита, которые диссоциировали в растворе на ионы. Степень диссоциации связана с константой диссоциации. Взаимосвязь между ними может быть найдена следующим образом. Если начальная концентрация растворенного слабого электролита равна С молей в 1 л, то после диссоциации в состоянии равновесия [ А ] аС; [ Х - ] аС; [ АХ ] ( 1 - а) С. [4]
А / дисс равно сумме электростатической энергии, требуемой для разделения ионов, и энергии связи BD, определяемой другими типами взаимодействия. Отметим, что электростатическая энергия в данном случае не зависит от температуры. Энтропийный член А5 представляет изменение энтропии, связанное в основном с образованием двух свободных ионов из одной ионной пары. [5]
Большой интерес представляет дисс. Рассуждение из натуральной богословии о начале и происшествии натурального богопочита ния ( 1769), посвященная гл. Противно натуре человеческой верить тому, чего в мыслях п в воображении представить не можно. Бога в троице - отмечал он - без откровения натурально понимать не можно ( Избр. По нек-рым сведениям, книга была публично сожжена на Лобном месте в Москве. Тценное за год до смерти ученого. [6]
Вычислив / ( дисс уксусной кислоты для растворов указанных концентраций, докажите, что константа диссоциации не зависит от концентрации раствора. [7]
Резцовые головки Глисон, дисс. [8]
Значения р / ( ДИсс, приведенные в таблице, подтверждают многое из того, о чем шла речь выше. Сила кислот в кислотных растворителях действительно меньше, чем в воде. Это обстоятельство позволяет уверенно связать ослабление кислот с химическими свойствами растворителей, поскольку даже в муравьиной кислоте, характеризующейся диэлектрической проницаемостью ( ДП 56), не намного уступающей воде ( ДП 78), те из кислот, которые в воде являются сильными, переходят в разряд слабых. [9]
Рассмотрим пример определения К ДИсс реагента, нейтральные молекулы которого способны присоединять протоны. [10]
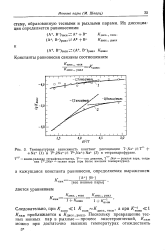 |
Температурная зависимость констант диссоциации T-Na Т - f - Na ( / и T2 - 2Na r. T2 - Na Na ( 2 в тетрагидрофуране. [11] |
Ккат приближается к / ( дисс. [12]
 |
Зависимость интегральной эн - ДН тальпии растворения КС1 от разбавления. [13] |
Энтальпия диссоциации Д / / ДИсс - это изменение энтальпии, сопровождающее распад 1 моль электролита на ионы. Энтальпии диссоциации разных слабых кислот и оснований различны как по значению, так и по знаку. Поэтому энтальпия нейтрализации в этих случаях будет неодинакова. [14]
А в а несян, автореферат дисс. [15]
Страницы: 1 2 3 4