Физическая адсорбция - азот
Cтраница 1
Физическая адсорбция азота позволяет установить общую площадь поверхности. Низкотемпературная ( - 183) хемосорбция СО является показателем доли поверхности, занятой атомами железа. Полученная величина не является ошибочно завышенной, так как слой хемосорбированных молекул может быть упакован более плотно, чем слой, удерживаемый физическими силами. Присутствие промоторов уменьшает эту величину, причем окись калия оказалась наиболее эффективной. Двуокись углерода хемосорбируется на окиси калия, находящейся на поверхности катализаторов. Это явление может служить основой для определения доли площади поверхности, занятой каждым компонентом катализатора. Повидимому, в свободных от щелочей катализаторах № 954 и № 424 промоторы-окислы занимают соответственно около 55 и 35 % поверхности. [1]
С другой стороны, физическая адсорбция азота или окиси углерода, или какого-либо другого газа происходит одинаково легко как на молекулах А12О3, так и на атомах железа. Этот факт делает невозможным определение части поверхности катализатора, покрытой промотором. Хотя влияние неоднородности поверхности на ван-дер-ваальсову адсорбцию не столь заметно, как на хемосорбцию, им нельзя ни в коей мере пренебрегать. Из предыдущих глав мы видели, что теоретически рассчитанные теплоты адсорбции газа на поверхностях углерода, металла или ионного кристалла не очень различны и что экспериментальные данные подтверждают теорию для менее активной, однородной части поверхности. Однако, несмотря на то, что теплота адсорбции молекул приблизительно одна и та же на гладких поверхностях углерода и железа, существует большое различие в том, испытывает ли молекула притяжение со стороны двух поверхностей углерода или со стороны одной. Другими словами, теплота адсорбции в узких трещинах и щелях резко отличается от теплоты на гладкой поверхности адсорбента. [2]
С другой стороны, физическая адсорбция азота или окиси углерода, или какого-либо другого газа происходит одинаково легко как на молекулах А1203, так и на атомах железа. Этот факт делает невозможным определение части поверхности катализатора, покрытой промотором. Хотя влияние неоднородности поверхности на ван-дер-ваальсову адсорбцию не столь заметно, как на хемосорбцию, им нельзя ни в коей мере пренебрегать. Из предыдущих глав мы видели, что теоретически рассчитанные теплоты адсорбции газа на поверхностях углерода, металла или ионного кристалла не очень различны и что экспериментальные данные подтверждают теорию для менее активной, однородной части поверхности. Однако, несмотря на то, что теплота адсорбции молекул приблизительно одна и та же на гладких поверхностях углерода и железа, существует большое различие в том, испытывает ли молекула притяжение со стороны двух поверхностей углерода или со стороны одной. Другими словами, теплота адсорбции в узких трещинах и щелях резко отличается от теплоты на гладкой поверхности адсорбента. [3]
На рис. 23 приведена идеализированная изотерма физической адсорбции азота ( при температуре его кипения) на крупнопористом силикагеле и изображены различные стадии насыщения геля жидкой фазой. [4]
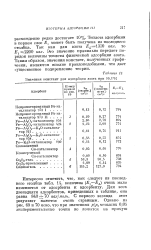 |
Значения констант для адсорбции азота при 90 1 К. [5] |
Это значение правильно передает порядок величины теплоты физической адсорбции азота. Таким образом, значения констант, полученных графически, являются вполне правдоподобными, что дает существенное подкрепление теории. [6]
Удельную поверхность катализатора обычно измеряют методом БЭТ по физической адсорбции азота. [7]
Однако Хардевелд и Монтфорт [11], детально исследовавшие в последнее время ИК-поглощение азота, адсорбированного на никеле, платине и палладии, показали, что оно является результатом физической адсорбции азота на особых центрах поверхности металла. Эти авторы обнаружили, что адсорбция азота при комнатной температуре, приводящая к появлению полосы поглощения в области 2200 - 2260 слГ1, не зависит от природы металла, но в то же время чрезвычайно чувствительна к размеру металлических частиц и может наблюдаться лишь на частицах диаметром от 15 до 70 А. Последнее обстоятельство позволило авторам предположить, что адсорбция азота связана с существованием на поверхности металла центров, зависящих от размера кристаллов. Существование таких центров подтверждается различием в дифференциальной теплоте адсорбции азота на образцах с размером металлических частиц 110 и 19 А, вычисленной из изотерм адсорбции. В то время как на первом образце теплота адсорбции медленно убывает от 4 до 2 ккал / молъ, на втором образце она быстро падает от 12 до 5 ккал / молъ и затем медленно уменьшается также до 2 ккал / молъ. В соответствии с этим изменение энтропии адсорбции свидетельствует о том, что при малых покрытиях молекулы азота, адсорбируясь на образце с размером металлических частиц 19 А, полностью утрачивают все поступательные и вращательные степени свободы, тогда как на образце с размером частиц 110 А при тех же покрытиях молекулы азота обнаруживают значительную подвижность. [8]
Однако Хардевелд и Монтфорт [ И ], детально исследовавшие в последнее время ИК-поглощение азота, адсорбированного на никеле, платине и палладии, показали, что оно является результатом физической адсорбции азота на особых центрах поверхности металла. Эти авторы обнаружили, что адсорбция азота при комнатной температуре, приводящая к появлению полосы поглощения в области 2200 - 2260 CM-i, не зависит от природы металла, но в то же время чрезвычайно чувствительна к размеру металлических частиц и может наблюдаться лишь на частицах диаметром от 15 до 70 А. Последнее обстоятельство позволило авторам предположить, что адсорбция азота связана с существованием на поверхности металла центров, зависящих от размера кристаллов. Существование таких центров подтверждается различием в дифференциальной теплоте адсорбции азота на образцах с размером металлических частиц 110 и 19 А, вычисленной из изотерм адсорбции. В то время как на первом образце теплота адсорбции медленно убывает от 4 до 2 ккал / молъ, на втором образце она быстро падает от 12 до 5 ккал1молъ и затем медленно уменьшается также до 2 ккал / молъ. В соответствии с этим изменение энтропии адсорбции свидетельствует о том, что при малых покрытиях молекулы азота, адсорбируясь на образце с размером металлических частиц 19 А, полностью утрачивают все поступательные и вращательные степени свободы, тогда как на образце с размером частиц 110 А при тех же покрытиях молекулы азота обнаруживают значительную подвижность. [9]
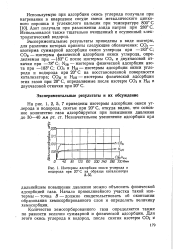 |
Изотермы адсорбции окиси углерода и. [10] |
Экспериментальные результаты приведены в виде изотерм, для различия которых приняты следующие обозначения: СОс - изотерма суммарной адсорбции окиси углерода при - 183 С; СОф - изотерма физической адсорбции окиси углерода, определяемая при - 183 С после изотермы СОс и двухчасовой откачки при - 78 С; N2 ( i) - изотерма физической адсорбции азота при - 183 С; COi и H2i - изотермы адсорбции окиси углерода и водорода при 20 С на восстановленной поверхности катализатора; СОц и Нгп - изотермы физической адсорбции этих газов при 20 С, определяемые после изотерм COi и H2i и двухчасовой откачки при 20 С. [11]
Далее мы установили, что поверх первого, прочно связанного поверхностного слоя имеется второй, более слабо удерживаемый слой СО, образовавшийся в результате процесса адсорбции с определенной энергией активации. Этот второй слой оказывает влияние на величину физической адсорбции азота. [12]
Работы д-ра Стоуна показали, что адсорбированные комплексы, которые вследствие своей конфигурации должны выступать над поверхностью, при последующей физической адсорбции инертного газа уменьшают его количество, адсорбируемое поверхностью. Примерно в то же время я показал, что прочная адсорбция окиси углерода не сказывается на последующей физической адсорбции азота. Это показывает, что молекулы СО очень близко прилегают к поверхности, возможно, располагаясь в междоузлиях, подобно тому, как это было описано Винфилдом. [13]
Теплота адсорбции в первом слое Е может быть получена из последнего столбца. Это значение правильно передает порядок величины теплоты физической адсорбции азота. Таким образом, значения констант, полученных графически, являются вполне правдоподобными, что дает существенное подкрепление теории. [14]
Неоднородность поверхности адсорбента сказывается значительно больше при хемосорбции, чем при ван-дер-ваальсовой адсорбции. Влияние неоднородности на хемосорбцию будет детально обсуждаться во II томе; здесь же мы поясним это на двух примерах. Во-первых, Брунауер и Эммет [41] нашли, что если часть поверхности железного катализатора покрыта слоем кислорода, то физическая адсорбция азота ( или любого другого газа) происходит одинаково легко как на части поверхности, покрытой кислородом, так и на неокисленных атомах железа, хемосорб-ция же водорода или окиси углерода исключена на окисленной части и протекает лишь на атомах железа. Если вся поверхность покрыта кислородом, хе-мосорбция водорода при - 78 или окиси углерода при - 183 почти полностью исключена, на физическую же адсорбцию азота окисление поверхности практически не оказывает влияния. [15]
Страницы: 1 2