Диссоциация - сопряженная кислота
Cтраница 1
Диссоциация сопряженных кислот 1 10-фенантролинов. [1]
Диссоциация сопряженных кислот - сулъфоношх сульфилиминов. [2]
Диссоциация сопряженных кислот альдегидов и кетонов. [3]
А пН - термодинамическая константа диссоциации сопряженной кислоты ВН; С, а и / - молярные концентрации, активность и коэффициенты активности, соответственно. [4]
Точно также можно поступать с константой диссоциации сопряженной кислоты Ка и выражать кислотность как трКа - lg Ka. В этом случае высокое значение трКа указывает на то, что сопряженная кислота является относительно слабой, а, следовательно, соответствующее основание - сильным. Хотя может показаться очень скучной необходимость характеризовать одно и то же свойство таким множеством способов, все-таки следует познакомиться со всеми этими способами и уметь ими пользоваться в ожидании того времени, когда общепринятым станет лишь один из них. [5]
Численные значения двух последних констант равны JT -, где Са - константа диссоциации сопряженной кислоты ( гл. [6]
При протонировании любого из ониевых оснований в качестве сопряженной кислоты образуется соответствующий ониевый катион. Основность этих оснований характеризуется константой Да диссоциации сопряженной кислоты. [7]
В-третьих, чтобы избежать выражения Къ в величинах 10П, принято измерять основность величиной рКъ - - lg Къ, так что сильное основание имеет низкую величину рКь, а слабое основание - высокую. Точно также можно поступать с константой диссоциации сопряженной кислоты Ка и выражать кислотность как рКа - lg Ka. В этом случае высокое значение рКа указывает на то, что сопряженная кислота является относительно слабой, а, следовательно, соответствующее основание - сильным. Хотя может показаться очень скучной необходимость характеризовать одно и то же свойство таким множеством способов, все-таки следует познакомиться со всеми этими способами и уметь ими пользоваться в ожидании того времени, когда общепринятым станет лишь один из них. [8]
Они нашли, что в каждом случае константы кислотности основного и нижнего тридлетного состояний близки, а для возбужденного синглетного состояния отличаются примерно в 10е раз. Так, например, для 2-нафтиламина константы диссоциации сопряженной кислоты RNH равны p / s0 4 1, yKSl - 2 и pKTl 3 3 и 3 1, определенные по методу импульсного фотолиза и по спектрам фосфоресценции соответственно. [9]
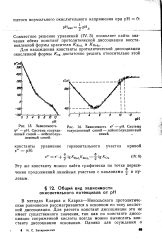 |
Зависимость рис 14. Зависимость е - рН. Система. [10] |
В методах Кларка и Кларка-Никольского протолитиче-ские равновесия рассматриваются в основном по типу кислотной диссоциации. Для расчета констант диссоциации это не имеет существенного значения, так как по константе диссоциации сопряженной кислоты всегда можно вычислить константу диссоциации основания. [11]
Как видно из таблицы, все приведенные константы диссоциации основаны на значении рКа 2 80 для кислоты, сопряженной аминоазобензолу, что является общепринятым значением для водного раствора. Следовательно, приведенные в табл. 58 результаты, не зависящие от среды, взятой в качестве кислотного растворителя, относятся к константам диссоциации различных сопряженных кислот ВН в водном растворе. [12]
Символы Ка и рКа употребляются для более распространенной формулировки понятия кислоты. Ка Ка, но Ка имеет более широкое значение, так как относится не только к диссоциации свободных кислот, но также к диссоциации сопряженных кислот, например солей слабых оснований и сильных кислот. [13]
Таким образом, это произведение не зависит от индивидуальных свойств сопряженной пары кислота - основание и является только функцией диссоциации растворителя. Из этой зависимости вытекают некоторые важные следствия. Если в растворителе с известным ионным произведением проходит реакция кислотной диссоциации, то, исходя из - значения ее константы диссоциации, легко вычислить константу диссоциации сопряженного основания. И наоборот, если известна константа диссоциации основания, то мы можем тут же рассчитать константу диссоциации сопряженной кислоты. Поэтому во многих современных руководствах в таблицах приводят не константы диссоциации кислот и независимо от них константы диссоциации оснований, а только константы кислотной диссоциации. [14]
Страницы: 1