Диссоциация - хлорноватистая кислота
Cтраница 1
Диссоциация хлорноватистой кислоты зависит от рН раствора, вследствие чего в направлении анода создается возрастающая концентрация гипохлоритных ионов. Благодаря отсутствию диафрагмы они взаимодействуют с едким натром, образуя гипо-хлорит натрия. [1]
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. [2]
В результате диссоциации хлорноватистой кислоты образуются гипохлоритные ионы ОС1 -, которые наряду с недиссоциированными молекулами хлорноватистой кислоты обладают бактерицидным свойством. [3]
Концентрация ионов СЮ, образующихся в анолите вследствие диссоциации хлорноватистой кислоты, незначительна и не вызывает существенного изменения хода анодного процесса. [4]
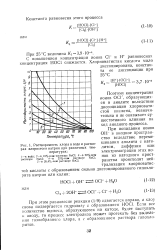 |
Растворимость хлора в воде и растворах хлористого натрия при различных температурах. [5] |
Поэтому концентрация ионов ОС1 -, образующихся в анолите вследствие диссоциации хлорноватистой кислоты, незначительна и не оказывает существенного влияния на ход анодного процесса. [6]
Если учесть, что хлористоводородная ( соляная) кислота представляет сильный электролит, а хлорноватистая кислота - слабый электролит ( константа диссоциации хлорноватистой кислоты при комнатной температуре равна К 3 6 - 10 - 8), как правильнее представить правую часть уравнения гидролиза хлора. [7]
Если учесть, что хлористоводородная ( соляная) кислота представляет сильный электролит, а хлорноватистая кислота - слабый электролит ( константа диссоциации хлорноватистой кислоты лри комнатной температуре равна К 3 6 - К) - 8), как правильнее представить правую часть уравнения гидролиза хлора. [8]
При этом окислительное действие оказывают как хлорноватистая кислота, так и гипо-хлоритный ион. Степень диссоциации хлорноватистой кислоты определяется величиной ipH воды: чем выше рН воды, тем больше эффект обеззараживания, так как выше содержание гипохлоритных ионов. [9]
Согласно закону действия масс хлор гидролизуется тем меньше, чем выше концентрация ионов водорода и хлора в электролите. Константа диссоциации хлорноватистой кислоты при 20 С равна только 3 7 - 10 - 8, поэтому реакцией ( 5) можно было бы пренебречь. [10]
Хлорноватистая кислота обладает более сильным бактерицидным действием, чем гипохлорит-ион. С увеличением степени диссоциации хлорноватистой кислоты при высоких значениях рН ( рис. 52) скорость бактерицидного действия значительно снижается. [11]
Эти равновесия осложняются медленным превращением гипохлорита в хлорид и хлорат, с происходящим в результате этого уменьшением активного хлора для отбелки. Эти побочные реакции происходят быстро для гипобро-мидных и еще быстрее для гипоиодидных систем. Знание того [344], что константа гидролиза хлора в воде равна 4 5ХЮ - 4, а константа диссоциации хлорноватистой кислоты [345, 346, 347] около 4ХЮ - 8, создает возможность-путем вычисления определить, что составы разбавленных растворов, употребляемых на практике ( содержащих больше или меньше 0 8 % активного хлора) меняются в зависимости от рН, как указано ранее. В результате этих окислений из отбеливаемых примесей образуются слабые органические кислоты, а из слабой хлорноватистой кислоты - сильная соляная кислота. Вследствие этого было тщательно изучено [345] как с теоретической [82], так и с практической [83] точек зрения, буферное действие присутствующего натриевого или кальциевого основания вместе с эффективностью добавления карбоната натрия или кальция, бората натрия, фосфатов, ацетата, цинкового и алюминиевого буферов. [12]
Страницы: 1