Диссоциация - метан
Cтраница 1
Диссоциация метана по схеме СН4 С 4Н сопровождается затратой 397 ккал / моль. [1]
Диссоциация метана по схеме СН4 С 4Н сопровождается затратой 1660 кДж / моль. [2]
Невидимому диссоциация метана вызывается не только влиянием поверхности, как указывают Бон и Ков: ард, но также и специфическим действием катализатора. Эти опыты были повторены Слэтером9 и дали новые результаты. [3]
Процесс диссоциации метана требует больших расходов энергии и может протекать лишь при высоких температурах. Независимо от метода подвода тепла равновесные концентрации ацетилена и других компонентов, получаемых при разложении углеводородов, являются функциями температуры. [4]
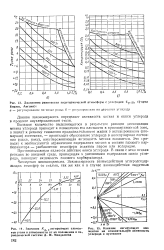
Однако скорость диссоциации метана при этих температурах еще недостаточна и практически для достижения приемлемых выходов водорода процесс приходится вести при температурах 1350 - 1400 С. [5]
Проведено исследование ионизации и диссоциации метана и ряда галоидонроизводных углеводородов. Установлены некоторые закономерности, описывающие влияние числа и природы атомов галоида, входящих в молекулу, на процессы ионизации и диссоциации. [6]
Большое количество выделяющегося в результате реакции диссоциации метана углерода приводит к повышению его плотности в приповерхностной зоне, а значит к резкому снижению продолжительности жизни в активированном ( атомарном) состоянии, - происходит образование углерода в молекулярном состоянии ( сажа, кокс), науглероживающая активность метана снижается. Это приводит к необходимости ограничения содержания метана в составе газового карбюризатора - разбавлению атмосферы водяным паром или водородом. [8]
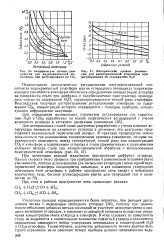 |
Эмпирические кривые равновесия для эндотермической атмосферы при регулировании по СО2.| Эмпирические кривые равновесия для эндотермической атмосферы при регулировании по содержанию Н2О. [9] |
Указанные реакции термодинамически более вероятны, чем реакция диссоциации метана с выделением свободного углерода [26], поэтому при сравнительно небольших добавках метана последний не участвует непосредственно в процессе насыщения углеродом, а повышает углеродный потенциал вследствие увеличения концентрации окиси углерода в атмосфере. В этих условиях на поверхности стали не выделяется в значительном количестве сажистый углерод и сохраняется однозначная зависимость между углеродным потенциалом и концентрацией Н2О и СО2 в атмосфере. [10]
Экспериментальные результаты, которые получили Holliday и Exell 6 по диссоциации метана при различных давлениях и температурах вплоть до 1200, показывают, что реакция приближается к равновесию, но это последнее не имеет ничего общего с настоящим обратимым равновесием. Они полагали, что это кажущееся равновесие получается вследствие отложения не чистого угля, но углеводорода, обладающего упругостью пара большей, чем у угля. Holliday и Exell заметили, как и многие другие исследователи, что никель чрезвычайно увеличивает скорость реакции. [11]
В настоящей главе рассматриваются термодинамические свойства некоторых наиболее простых радикалов - продуктов диссоциации метана, его фтор - и хлорзамещенных, а также ацетилена и его фторзамещенных. Можно предполагать, что отсутствие данных по другим радикалам, в том числе содержащим два и более атомов углерода, не должно серьезно повлиять на точность термодинамических расчетов, так как стабильность радикалов, не рассмотренных в Справочнике, сравнительно мала. Нужно отметить, что даже рассматриваемые в Справочнике радикалы в большинстве малостабильные соединения, а остальные радикалы, за исключением, быть может, СВг3, CJ3, CBr2 и CJ2, еще менее стабильны. В частности, можно ожидать, что радикалы, содержащие одновременно галоид и водород должны легко распадаться на углерод в твердом состоянии, галоидоводород и другие продукты разложения. [12]
Из предложенных нами схем следует также, что образование CH3D, не требующее предварительной диссоциации метана на СН3 и Н, должно протекать с меньшей энергией активации. [13]
Суммарное выделение тепла получается меньшим, чем при сгорании кокса, ввиду затрат на диссоциацию метана и других углеводородов. Кроме того, кокс вносит в горн физическое тепло, накопленное им при продвижении по высоте печи, а природный газ вводится в горн холодным. Горение же природного газа дает значительно больший объем продуктов сгорания. При сгорании у фурм кокса до СО на 1 кг углерода выделяется 9828 кдж / моль ( 2390 ккал / моль) и образуется 5 38 м3 продуктов сгорания, а при сгорании СН4 до СО и Н2 на 1 кг углерода приходится 3108 кдж / моль ( 740 ккал / моль) и образуется 9 11 м3 продуктов сгорания. Поэтому при вдувании природного газа понижается максимальная температура в очагах сгорания и средняя температура горна. [14]
Заметим кроме того, что, если учитывать отклонение от идеальности при высоких давлениях, то степень диссоциации метана существенно иная, нежели в предположении совершенного газа. [15]
Страницы: 1 2 3