Диссоциация - молекула - растворенное вещество
Cтраница 1
Диссоциация молекулы растворенного вещества, состоящей из взаимосвязанных ионов, происходит при ее столкновении с другой молекулой ( растворителя или растворенного вещества), имеющей достаточно большую кинетическую энергию теплового движения. Интенсивная диссоциация кислот, солей и щелочей в водных растворах связана с тем, что молекулы воды обладают большим электрическим моментом, т.е. подобны сильно вытянутым диполям. Под влиянием электрического поля, создаваемого полярной молекулой кислоты, соли или щелочи, окружающие ее диполи воды ориентируются преимущественно таким образом ( рис. 11.1), что своим электрическим полем существенно ослабляют связь между ионами этой молекулы и тем самым облегчают ее диссоциацию. [1]
Приняв диссоциацию молекул растворенного вещества на ионы, можно качественно объяснить те свойства электролитов, которые отличают их от растворов обычных, не проводящих тока. [2]
Вследствие растворения солей и других соединений в водной среде происходит диссоциация молекул растворенного вещества. [3]
Вследствие растворения солей и других соединений в водной среде происходит диссоциация молекул растворенного вещества, Результат этого процесса - возникновение на контакте двух электролитов различной концентрации например, пластовой воды и бурового раствора, диффузионной разности потенциалов. [4]
Подобное же ненормально большое понижение температуры замерзания водных растворов, вызванное диссоциацией молекул растворенного вещества, обнаруживает большинство кислот, щелочей и солей. Предположение о распаде ( диссоциации) молекул указанных веществ в водном растворе на частицы более мелкие, чем молекулы, нашло полное подтверждение в теории электролитической диссоциации, разбору которой посвящена следующая глава. [5]
Закон Ламберта - Беера выполняется, если при изменении концентрации не происходит агрегации или диссоциации молекул растворенного вещества. [6]
Введенное здесь Аррениусом выражение коэффициент активности, конечно, было неудачным и, видимо, имело целью замаскировать основную идею о диссоциации молекул растворенных веществ из-за опасения резких возражений физиков. [7]
Дистиллированная вода, полученная повторной перегонкой, практически не обладает электропроводностью, имея сопротивление более 108 Ом см. За счет растворения в воде некоторых солей, оснований или кислот полученные растворы становятся хорошими проводниками электрического тока, что обусловливается диссоциацией молекулы растворенного вещества на ионы, поэтому процесс еще называется ионизацией. [8]
В зависимости от состояния веществ в растворе выделяют растворы электролитов и неэлектролитов - молекулярные растворы. Растворы электролитов содержат ионы, образовавшиеся при диссоциации молекул растворенного вещества или при разъединении в среде растворителя ионов, уже имевшихся в кристалле. В растворах неэлектролитов заряженные частицы в сколько-нибудь ощутимых количествах отсутствуют. [9]
И растворитель, и растворенное вещество оказывают значительное влияние друг на друга и взаимно изменяют свои свойства. Степень этого влияния зависит от природы того и другого вещества, и оно наиболее существенно проявляется в диссоциации молекул растворенного вещества или их ассоциации. Преимущественное прохождение того или иного процесса определяется концентрацией вещества в растворе, температурой и соотношением полярностей растворителя и растворенного вещества. [10]
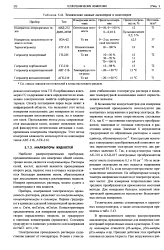 |
Технические данные дымомеров и влагомеров. [11] |
Наиболее распространенными приборами, предназначенными для измерения общей концентрации ионов, являются кондуктометры. Растворы солей, кислот, щелочей являются проводниками второго рода, перенос тока в которых осуществляется благодаря движению ионов, образующихся при диссоциации молекул растворенных веществ. Измеряя проводимость раствора, можно судить о концентрации в нем веществ. [12]
Если растворы представляют собой простые механические смеси, то при одинаковой степени ассоциации или диссоциации молекул растворенного вещества следует ожидать одинаковых спектров поглощения. При различной степени ассоциации или диссоциации растворенных молекул или при образовании сольватов вопрос мог быть решен только систематическим изучением спектров поглощения растворов разной концентрации при различных температурах. [13]
Согласно данным Пората [12], увеличение ионной силы от 0 01 до 0 2 незначительно влияет на величины элюирующих объемов аминокислот и белков при использовании колонок с сефадексом. Однако 0 5 М Na резко уменьшает величину элюирующего объема лизоцима. При более высоких ионных силах может наблюдаться денатурация и влияние на результаты фракционирования ассоциации или диссоциации молекул растворенного вещества. Средние значения ионной силы и рН не оказывают заметного влияния на размер пор гелей. [14]
Отношение числа молекул, распавшихся на ионы, к первоначальному числу всех молекул растворенного вещества называют степенью диссоциации и обозначают буквой а. Она увеличивается с разбавлением раствора. При бесконечном разбавлении степень диссоциации приближается к единице, что соответствует полной, 100 % - ной, диссоциации молекул растворенного вещества на ионы. [15]
Страницы: 1