Диссоциация - водород
Cтраница 2
Происходящая на поверхности диссоциация водорода, сопровождающаяся испарением с нити атомного водорода, поглощает большое количество теплоты; когда же атомы рекомбкнируют на стенках или в пространстве внутри баллона, часть этой теплоты возвращается. Таким образом, газ несет с собой больше теплоты ( в виде химической энергии диссоциированных атомов водорода), чем могло бы быть перенесено недиссоциированными молекулами водорода в виде кинетической энергии их движения. [16]
В этих случаях диссоциация водорода энергетически возможна лишь при условии одновременного образования молекул гидридов CdH и ZriH, так как при этом выделяются дополнительные порции энергии, разные энергии диссоциации молекул CdH ( 15 6 ккал) и ZnH ( 19 6 ккал), вследствие чего процессы Cd H2 CdH H 1 6 ккал и Zn H2 ZnH H - t - 10 l ккал оказываются экзотермическими. [17]
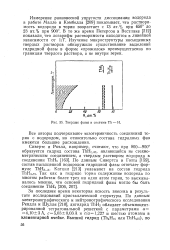 |
Твердые фазы в системе Th - Н. [18] |
Измерение равновесной упругости диссоциации водорода в работе Малле и Кэмбелла [209] показывает, что растворимость водорода в тории возрастает с 13 ат. [19]
Из того, что диссоциация водорода протекает уже при обычной температуре, можно сделать вывод, что она не может быть стадией, ограничивающей скорость процесса синтеза аммиака. [20]
Последняя работа по исследованию диссоциации водорода на чистых вольфрамовых нитях описана у Вгусе и R о b e r t s, Proc. [21]
Полученные величины тепловых эффектов диссоциации водорода не следует трактовать в абсолютном смысле, их можно рассматривать лишь в соотношении между собой. Из представленных в табл. 1.26 результатов видно, что гетеролитическая диссоциация водорода на ионных парах всегда выгоднее гемолитической диссоциации, так как в большинстве случаев является экзотермическим процессом, в то время как гемолитическая диссоциация всегда является эндотермической. [22]
 |
Значения разностей энтальпий некоторых веществ при стандартных условиях. [23] |
Определить разность энтальпий реакции диссоциации водорода при Г1000 К, используя данные табл. 6.1 и уравнения температурной зависимости теплоемкостей. [24]
Полученные величины тепловых эффектов диссоциации водорода не следует трактовать в абсолютном смысле, их можно рассматривать лишь в соотношении между собой. Из представленных в табл. 1.26 результатов видно, что гетеролитическая диссоциация водорода на ионных парах всегда выгоднее гемолитической диссоциации, так как в большинстве случаев является экзотермическим процессом, в то время как гемолитическая диссоциация всегда является эндотермической. [25]
Палладий - наилучший катализатор диссоциации водорода, но он не годится для водородного электрода, так как в его металлическую фазу проникает большое количество атомов водорода. После этого атомы водорода теряют контакт с жидкой фазой, с которой они должны оставаться в равновесии. Удовлетворительные результаты дает тонкий слой палладия, осажденный на золоте или платине. Наилучшим металлом для водородного электрода является платинированная платина благодаря своей большой площади поверхности, хотя она и несколько проницаема для атомов водорода. В тех случаях, когда наличие платинированной платины в растворе ускоряет какие-либо посторонние реакции гидрогенизации в неводных или частично водных растворах, можно использовать полированную платину или золото. Поверхность полированной платины или золота следует активировать анодной обработкой или химически с помощью сильно окисляющих реагентов, таких, как хромовая кислота или царская водка. В качестве катализаторов для реакции диссоциации водорода пригодны также переходные металлы благодаря своим не полностью заселенным d - орбиталям. [26]
Однако характер зависимости скорости диссоциации водорода от его парциального давления определяется природой реакции и механизмом и не может зависеть от того, какое стехиометри-ческое уравнение этой реакции мы выбрали. [27]
При повышении температуры, когда диссоциация водорода становится значительной, молекулярные полосы слабеют и отчетливо выступают линии атомарного водорода в сериях Лаймана, Бальмера, Пашена. По мере дальнейшего нагревания плазмы к хвостам серий начинает примыкать все более яркий рекомбинационный континуум - результат свободно-связанных переходов. Усиление рекомбинационного свечения свидетельствует о возрастании степени ионизации. [28]
Палладий - - наилучший катализатор диссоциации водорода, но он не годится для водородного электрода, так как в его металлическую фазу проникает большое количество атомов водорода. После этого атомы водорода теряют контакт с жидкой фазой, с которой они должны оставаться в равновесии. Удовлетворительные результаты дает тонкий слой палладия, осажденный на золоте или платине. Наилучшим металлом для водородного электрода является платинированная платина благодаря своей большой площади поверхности, хотя она и несколько проницаема для атомов водорода. В тех случаях, когда наличие платинированной платины в растворе ускоряет какие-либо посторонние реакции гидрогенизации в неводных или частично водных растворах, можно использовать полированную платину или золото. Поверхность полированной платины или золота следует активировать анодной обработкой или химически с помощью сильно окисляющих реагентов, таких, как хромовая кислота или царская водка. В качестве катализаторов для реакции диссоциации водорода пригодны также переходные металлы благодаря своим не полностью заселенным rf - орбиталям. [29]
 |
Кривая зависимости сила тока - напряжение, построенная по данным линейного отклонения потенциала при осаждении водорода на платиновом электроде из раствора 0 5 М H2SO4 в ультрачистой воде. [30] |
Страницы: 1 2 3 4