Диссоциация - ионогенная группа
Cтраница 4
Объяснение этому авторы видят в том, что с повышением температуры возрастает диссоциация ионогенных групп ДЭАЭ-целлюлозы ( рис. 3), а следовательно и величина ее заряда, что повышает сорбци-онную емкость сорбента к сорб-тиву. [46]
Это означает ( см. уравнение 6.183), что численные значения констант диссоциации ионогенных групп, контролирующих ферментативную реакцию ( / Са и Дгв на схеме 6.177), близки, так что раздельное определение этих констант каким-либо из перечисленных графических методов не представляется возможным. [47]
Коагуляции гидратнрованных высокомолекулярных веществ мешает водная оболочка и электрический заряд, обусловленный диссоциацией ионогенных групп, а в ряде случаев также адсорбцией ионов электролитов из раствора на поверхности частиц. Главным фактором устойчивости большинства гидрофильных коллоидов является их водная оболочка, препятствующая коагуляции частиц даже в изоэлектрическом ( электронейтральном) состоянии. [48]
Сущность направленного диссоциационного механизма заключается в том, что ионы, появляющиеся в результате диссоциации ионогенных групп, переходят в соседний слой не только по вакансиям, но и по междуузлиям, с последующим связыванием этих ионов в узлах. [49]
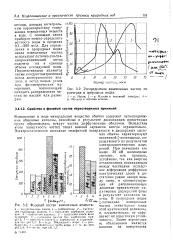 |
Распределение взвешенных частиц по размерам в природных водах. [50] |
Взвешенные в воде минеральные вещества обычно содержат легкоподвижные обменные катионы, способные в результате диссоциации ионогенных групп образовывать вокруг частиц диффузионные оболочки. Вследствие этого поверхность частиц таких взвесей заряжена всегда отрицательно. Электростатическое состояние межфазной поверхности в дисперсных системах обычно характеризуют величиной - потенциала, определяемого по результатам электрокинетических измерений. [51]
Это имеет место, в частности, при образовании заряда на поверхности за счет диссоциации ионогенных групп или тогда, когда переход ионов с поверхности в раствор и наоборот, из раствора на поверхность, требует определенной энергии активации: при наличии барьера изменение заряда поверхности происходит медленнее, чем процесс сближения частиц. В то же время этот барьер не мешает миграции ионов по поверхности, позволяющей принимать, что заряд распределен по поверхности равномерно. [52]
Если на поверхности частиц при адсорбции макромолекул возникает граннчный потенциал ( возможно, за счет диссоциации ионогенных групп или ориентации диполей), то даже в растворителях с малой величиной диэлектрической постоянной получаются устойчивые суспензии. На микрофотографиях в этом случае наблюдается оптимальное диспергирование. Такой же эффект может быть достигнут путем прибавления потенциалообразующих ионов, например, кротоновой кислоты, как это известно для гидрофобных коллоидов. Независимо от образования двойных электрических слоев адсорбирующиеся макромолекулы оказывают специфическое действие на устойчивость суспензий. Это объясняется тем, что одна и та же макромолекула адсорбируется на двух или нескольких частицах и между ними образуются мостики. При больших концентрациях высокомолекулярных веществ, достаточных для образования сплошного адсорбционного слоя, напротив, наблюдается повышение устойчивости суспензий. Электронные микрофотографии при этом указывают на образование адсорбционных оболочек толщиной вплоть до 800 А. Как видно на фото 28, б, в случае поли-стирольного латекса с насыщенным адсорбционным слоем, шаровидная форма частип теряется в результате высушивания препарата и осуществления при этом плотной упаковки частиц, но стабилизированные частицы сохраняют индивидуальность. Причина стабилизирующего действия толстых слоев заключается, по мнению автора, в том, что при сближении адсорбционных слоев двух частиц возникают силы отталкивания вследствие уменьшения конфигурационной энтропии макромолекул в области перекрывания защитных слоев. [53]
Электрические заряды на коллоидных частицах возникают в результате преимущественной адсорбции одного из ионов электролитов из раствора или диссоциации собственных ионогенных групп. Независимо от механизма возникновения зарядов на коллоидных частицах, при достаточной плотности расположения зарядов, образуется двойной электрический слой, состоящий из зарядов на поверхности и из компенсирующих ионов в растворе; при этом, по теории Штерна, компенсирующие ионы частично входят в прилегающий к поверхности адсорбционный слой, а частично - в диффузную часть двойного слоя. [54]
Электрические заряды на коллоидных частицах возникают в результате преимущественной адсорбции одного из ионов электролитов из раствора или диссоциации собственных ионогенных групп. Независимо от механизма возникновения зарядов на коллоидных частицах, при достаточной плотности расположения зарядов образуется двойной электрический слой, состоящий из зарядов на поверхности частицы и из компенсирующих ионов в растворе; при этом, по теории Штерна, компенсирующие ионы частично входят в прилегающий к поверхности адсорбционный слой, а частично - в диффузную часть двойного слоя. [55]
Страницы: 1 2 3 4