Cl-ион
Cтраница 1
Cl-иона, по которому вычисляют содержание NaCl. Для определения СаО и MgO растворяют 20 г селитры в 1000 мл кипящей воды и в 500 мл этого раствора определяют известь осаждением щавелевокислым аммонием, а магнезию - фосфорнокислым аммонием. [1]
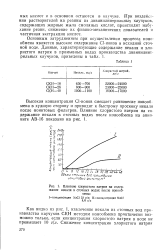 |
Влияние хлористого натрия на содержание некаля в сточных водах после ионосб. [2] |
Высокая концентрация Cl-ионов смещает равновесие ионооб-мена в худшую сторону и приводит к быстрому проскоку некаля после ионитовых фильтров. [3]
Невидимому, при ПО ата вынос Cl-иона с паром связан только или почти исключительно с капельным уносом. Однако при давлении 185 ата, хотя и имеется в отличие от кремнекислоты зависимость коэффициента выноса Cl-иона от нагрузки зеркала испарения, но она несравненно слабее, чем для всех остальных примесей. [4]
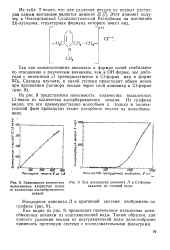 |
Зависимость количества [ IMAGE ] Ход насыщения анионита Л в Cl-форме вытесненных хлористых ионов некалем из сточной воды. [5] |
На рис. 8 представлена зависимость количества выделенных Cl-ионов от количества адсорбированного некаля. Из графика видно, что это преимущественно ионообмен и только в окончательной фазе происходит также адсорбция некаля на ионообмен-нике. [6]
Повидимому, при давлении 185 ата вынос Cl-иона вызывается не только капельным уносом и появляется новый фактор - растворимость NaCl непосредственно в паре при столь высоких давлениях, как 186 ата. [7]
Связь Zr с ОН-ионами прочнее, чем с Cl-ионами, поэтому вытеснение последних при взаимодействии циркония с ксиленоловым оранжевым происходит легче. Нагревание раствора соли циркония при невысокой кислотности до прибавления реагента приводит к более глубокому гидролизу, и оптическая плотность для предварительно нагретых растворов несколько ниже, чем для ненагретых. Нагревание растворов с концентрацией циркония 1 10 - 3 М и рН; 2 перед добавлением реагента приводит к полной потере, реакционной способности циркония. [8]
 |
Прибор для определения чисел переноса ионов через мембраны по аналитической методике. [9] |
Для вольтаметра пользуются 15 % раствором KNO3 свободного от Cl-ионов, которым наполняется немного более половины трубки вольтаметра. В нижнюю часть трубки помещается серебряный электрод. В раствор азотной кислоты помещают вверху платиновый электрод, являющийся катодом. Серебряный электрод, погруженный в раствор КМОз, является анодом. [10]
При повышении температуры среды или наличии в ней активаторов, например Cl-ионов, концентрацию ингибиторов необходимо уве личить. [11]
Исследование было проведено в 1933 г. Более точные методы определения концентраций Cl-иона, пригодные для малых их значений, примененные, в частности, в работе ЭНИН, были разработаны много позднее. [12]
Для усиления эффективности ингибиторов при сернокислотном травлении практикуется введение в травильные растворы Cl-ионов. [13]
Общей гидрохимической закономерностью процессов теплового воздействия является увеличение минерализации вод, содержания в них Cl-иона ( С1 НСОз) по направлению от паронагнетательных скважин к добывающим, а в добывающих, соответственно, - уменьшение этих параметров во времени. Гидродинамический метод является наиболее простым в исполнении и дающим достаточно высокую информацию. Его применение дает возможность оперативно и с небольшими затратами определять основные направления движения фильтрационных потоков и выявлять зоны гидрохимического регулирования. [14]
Таким образом, степень гидрохимического реагирования скважин на процесс определяется степенью содержаний в водах Cl-ионов по сравнению с фоновыми значениями. Снижение содержания С1 - иона указывает на то, что к данной скважине подошла определенная доля слабоминерализованной конденсационной воды. Следовательно, пластовые воды околоскважинного пространства реагируют на закачку теплоносителя. [15]
Страницы: 1 2 3