Вольт-эквивалент
Cтраница 1
Вольт-эквивалент равен изменению энергии при переносе одного грамм-моля одновалентного иона через разность потенциалов в ] вольт; 1 вольт-эквивалент равен 23066 кал. [1]
Фарадея для перехода от вольт-эквивалентов к килокалориям на моль); величина 2 303 переводит логарифм натуральный в логарифм десятичный ( In / С в lg / С); л - число электрон-эквивалентов, обмениваемых в суммарной реакции; Е - стандартный потенциал элемента; константа R 1 9872 кал моль - К 1; К - константа равновесия для суммарной реакции. [2]
Недавно Фрост предложил использовать термин вольт-эквивалент ( ВЭ) для обозначения произведения стандартного окислительного потенциала Е рассматриваемого химического элемента на его степень окисления. [3]
Изменение свободной энергии в окислительно-восстановительной реакции можно также связать с ее вольт-эквивалентом ( см. разд. Изменение свободной энергии, как и вольт-эквивалент реакции, связано с ее электрохимическим потенциалом и изменением степени окисления. Это позволяет построить диаграмму Фроста ( см. рис. 16.9 и 16.10), на которой, кроме вольт-эквивалентов, будут указаны изменения свободной энергии; ДО откладывают по ординате, параллельной ординате вольт-эквивалентов. [4]
Хотя работа выхода преобразователя в режиме максимальной мощности не может быть больше вольт-эквивалента температуры V, если работа выхода коллектора больше, чем эмиттера, теоретический анализ показывает, что работу выхода коллектора вовсе необязательно сводить к минимуму. Можно вывести соотношение, которое тесно связывает минимальную работу выхода коллектора с заданным отношением температур эмиттера и коллектора. [6]
На диаграмме Фроста, изображенной на рис. 16.9, иону нитрата соответствуют степень окисления 5 и вольт-эквивалент ВЭ 1 25 В-5 6 25 В. [7]
Вольт-эквивалент равен изменению энергии при переносе одного грамм-моля одновалентного иона через разность потенциалов в ] вольт; 1 вольт-эквивалент равен 23066 кал. [8]
Способ вычисления Е [ 4 - ( - 1 23) - 2 - ( - 0 69) ] / 2 - 1 76в показывает, что при такого рода суммировании отдельных потенциалов нужно всегда складывать вольт-эквиваленты. [9]
Изменение свободной энергии в окислительно-восстановительной реакции можно также связать с ее вольт-эквивалентом ( см. разд. Изменение свободной энергии, как и вольт-эквивалент реакции, связано с ее электрохимическим потенциалом и изменением степени окисления. Это позволяет построить диаграмму Фроста ( см. рис. 16.9 и 16.10), на которой, кроме вольт-эквивалентов, будут указаны изменения свободной энергии; ДО откладывают по ординате, параллельной ординате вольт-эквивалентов. [10]
Изменение свободной энергии в окислительно-восстановительной реакции можно также связать с ее вольт-эквивалентом ( см. разд. Изменение свободной энергии, как и вольт-эквивалент реакции, связано с ее электрохимическим потенциалом и изменением степени окисления. Это позволяет построить диаграмму Фроста ( см. рис. 16.9 и 16.10), на которой, кроме вольт-эквивалентов, будут указаны изменения свободной энергии; ДО откладывают по ординате, параллельной ординате вольт-эквивалентов. [11]
Изменение свободной энергии в окислительно-восстановительной реакции можно также связать с ее вольт-эквивалентом ( см. разд. Изменение свободной энергии, как и вольт-эквивалент реакции, связано с ее электрохимическим потенциалом и изменением степени окисления. Это позволяет построить диаграмму Фроста ( см. рис. 16.9 и 16.10), на которой, кроме вольт-эквивалентов, будут указаны изменения свободной энергии; ДО откладывают по ординате, параллельной ординате вольт-эквивалентов. [12]
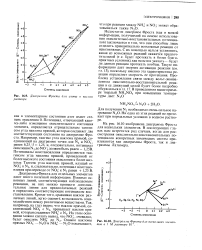 |
Диаграмма Фроста для азота в кислом растворе.| Диаграмма Фроста для нескольких элементов в 1 М растворе Н. [13] |
Недостаток, диаграмм Фроста ( как и всякой информации, получаемой на основе использования окислительно-восстановительных потенциалов) заключается в том, что они способны лишь отделить принципиально возможные реакции от невозможных. Такую информацию дает энергия активации реакции ( см. гл. Проблема установления связи между вольт-эквивалентом окислительно-восстановительной реакции и ее движущей силой будет более подробно обсуждаться в гл. [14]
Страницы: 1
