1-механизм
Cтраница 1
Вероятность SN 1-механизма уменьшается в апротонных растворителях, не способных сольватировать отщепляющийся анион. Замещение в этом случае происходит по SN 2-механизму и не сопровождается перегруппировкой. [1]
В случае реакции неопентилбромида по SN 1-механизму происходит изомеризация радикала, в то время как в реакциях SN 2-типа такая изомеризация не имеет места. [2]
 |
Аллилыия перегруппировка при иуклеофнльном замещении. [3] |
Ясно, что iSy - механизм является специальным случаем 5 1-механизма, в котором уходящая группа имеет сложное строение. [4]
Из рис. 17 и 18 следует, что при 5л - 1-механизм. Промежуточный катион здесв легко доступен для атаки нуклеофильного партнера с обеих сторон. Поэтому энтропия активации низкая. Напротив, при 5д - 2-реакциях образование переходного состояния требует совершенно определенного расположения пуклео-фильного соединения, и комплекс обладает высокой степенью упорядоченности. Поэтому энтропия активации принимает в этом случае сильно отрицательные значения. Если остатки R очень объемистые, то по той же причине S. Поэтому мономолекулярная реакция с ее плоским промежуточным продуктом протекает легко вследствие незначительных пространственных требований. [5]
Некоторые катализируемые кислотами реакции сольволиза эпокси-соединений протекают, по-видимому, по 8 1-механизму с промежуточным образованием карбониевых ионов. Это лучше всего видно на примере реакций несимметричных а-окисей. [6]
Это объясняется тем, что реакция с электрофильными реагентами протекает по SN 1-механизму ( образуются развитые карбо-катионы), а с нуклеофильными-по SN 2-механизму. [7]
Однако трудно представить, что i-либо реакция будет идти параллельно по классическому и классическому 5 1-механизму, поскольку структурные тре - t для этих механизмов очень сильно различаются. [8]
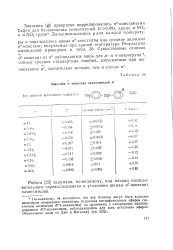 |
Значения сг-констант заместителей R. [9] |
По-видимому, не исключено, что эти отличия могут быть вызваны некоторым изменением механизма гидролиза нитрофениловых эфиров ( частичное включение В 1-механизма) по сравнению с однородным ацилкис-лородным В 2-механизмом, соблюдающимся для всех остальных эфиров. [10]
Процесс замещения гидроксильной группы на галоген может в зависимости от строения спирта и условий реакции происходить по SN2 - иди 5 1-механизмам. Знание материала предыдущих глав позволяет определить, каким образом будет протекать та или иная реакция, и выбрать оптимальные условия ее проведения. [11]
Как видим, влияние заместителей на гидролиз ортоэфиров не только намного меньше по сравнению с ацеталями, гидролиз которых протекает по SN 1-механизму, но в некоторых случаях прямо противоположно. Так, этилортокарбонат и этилортобензоат, которые, как известно, образуют более стабильные карбониевые ионы [ в ], гидролизуются более медленно, че м этилортоформиат и этилортоацетат. [12]
Это обстоятельство послужило для американских авторов основанием, чтобы высказаться в пользу того, что описываемые реакции протекают в соответствии с S 1-механизмом. [13]
В этаноле четвертичные соли, образованные из триэтилфос-фита, подвергаются сольволизу в присутствии больших концентраций амина, давая простой эфир и один эквивалент кислоты [30], что указывает на 5 1-механизм. [14]
Помимо стерических препятствий, на способ элиминирования могут влиять еще два фактора, а именно уже упомянутые выше факторы, способствующие мономолекулярному элиминированию: 1) степень стабилизации образующейся двойной связи за счет сопряжения или гиперконъюгации с соответствующими заместителями и 2) легкость отрыва протона. Если это 1-механизм, то тогда отрыв протона от карбониевого иона облегчается тем же самым фактором, поскольку при этом образуется алкен ( стр. Если это - механизм, то переходное состояние, ведущее к алкену, также стабилизируется благодаря возникающему сопряжению. Так, в приведенном выше примере Е - дегидробромирования 2-бромбутана образование продукта Зайцева с выходом 80 % ( по сравнению с 20 % - ным выходом бутена-1) объясняется не тем, что последний является термодинамически менее устойчивым продуктом, хотя это верно ( стр. II, приводящее к бутену-1, менее устойчиво, чем переходное состояние I, приводящее к бутену-2. [15]
Страницы: 1 2