Восстановление - гидропероксид
Cтраница 1
Восстановление гидропероксидов иодид-ионом - самый распространенный и наиболее общий метод анализа гидропероксидов. [1]
Восстановление гидропероксидов хлоридом двухвалентного олова и титрование избытка восстановителя позволяют исключить помехи, создаваемые в иодид-ном методе соединениями серы, которые поглощают иод. Этот метод, хотя и дает точные результаты, но длинен и сложен в исполнении, поскольку требует тщательной продувки азотом и отсутствия других способных восстанавливаться пероксидных соединений. [2]
Восстановление гидропероксидов иодид-ионом - самый распространенный и наиболее общий метод анализа гидропероксидов. [3]
Восстановление гидропероксидов хлоридом двухвалентного олова и титрование избытка восстановителя позволяют исключить помехи, создаваемые в иодид-ном методе соединениями серы, которые поглощают иод. Этот метод, хотя и дает точные результаты, но длинен и сложен в исполнении, поскольку требует тщательной продувки азотом и отсутствия других способных восстанавливаться пероксидных соединений. [4]
Реакции восстановления гидропероксидов характеризуются цепным механизмом того же типа, что и восстановление пероксида водорода; кроме того, радикал RO - может вступать в различные реакции перегруппировки. [5]
Иод, выделяющийся при восстановлении гидропероксида, через 30 мин титровали тиосульфатом. Присутствие тал - лийорганических соединений ( Сд Н5) з Т1, ( СБ Н, ) Т I X, ( С2Н5) 2Т1Х, где X ОН. [6]
В результате изучения закономерностей реакции восстановления гидропероксида циклооктаиа водородом в жидкой фазе рекомендованы условия, обеспечивающие количественное превращение гидропероксида циклооктана в циклооктаиол. [7]
В результате изучения закономерностей реакции восстановления гидропероксида циклооктана водородом в жидкой фазе рекомендованы условия, обеспечивающие количественное превращение гндропероксида циклооктана в циклооктапол. [8]
Определение гидропероксида иодо-метрическим методом основано на восстановлении гидропероксида иодидом калия в кислой среде. [9]
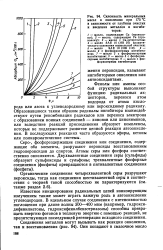 |
Склонность минеральных масел к окислению при 175 С в зависимости от глубины очистки и введения металлов и ингибиторов. [10] |
Серо -, фосфорсодержащие соединения или соединения, содержащие оба элемента, разрушают пероксиды восстановлением гидропероксидов до спиртов. Атомы серы или фосфора соответственно окисляются. [11]
Реакция катализируется одноэлектронными окислительно-восстановительными реагентами ( обычно используются соли или комплексы переходных металлов Со, Си, Fe, Mn, Rh и Ir) и протекает с разложением образующегося гидропероксида. Реакции, используемые в промышленности ( см. табл. 4.1.1), обычно проводятся в жидкой фазе при умеренных температурах и давлении. В процессе Хал-кона восстановление гидропероксида [ схема ( 2) ] сочетается с получением пропеноксида. В реакции Башкирова ( аутоокисление в присутствии борной кислоты) образование эфиров борной кислоты, предохраняющее от дальнейшего окисления, дает возможность увеличить выход вторичных спиртов. [12]
Страницы: 1