Высокая электропроводность - металл
Cтраница 4
Специфическими свойствами металла являются большие теплопроводность и электропроводность, металлический блеск, непрозрачность для всех длин волн видимого света и наличие плот-нейших упаковок. Теории строения металлов в первую очередь должны удовлетворительно объяснить эти свойства. Ранние теории объясняли высокую электропроводность металла, опираясь на модель, в которой свободные электроны движутся в правильной сетке из положительных металлических ионов. Электроны рассматривали движущимися свободно по законам классической статистики наподобие молекул газа и устойчивость металла считали следствием сил притяжения между положительными ионами и электронным газом. Это представление впервые было предложено Друде и впоследствии расширено Лоренцом. [46]
Металл состоит из ион-атомов, образующих кристаллическую решетку, которая заполнена электронами. Электроны, заполняющие объемную кристаллическую решетку, относительно легкоподвижны, вследствие чего их часто называют электронным газом. Эта их подвижность обусловливает высокую электропроводность металлов. Ион-атомы, находящиеся в узлах пространственной кристаллической решетки, не столь подвижны, они колеблются около положения равновесия с тем большим размахом ( амплитудой), чем выше температура. [47]
Наличие свободных электронов во всех металлических структурах обусловливает существование общих свойств металлов. Сюда относятся прежде всего такие характерные для них внешние признаки, как непрозрачность, металлический блеск и большей частью серый цвет. Со свободой перемещения электровоз связаны высокая электропроводность металлов и их хорошая теплопроводность. [48]
Наличие свободных электронов во всех металлических структурах обусловливает существование общих свойств металлов. Сюда относятся прежде всего такие характерные для них внешние признаки, как непрозрачность, металлический блеск и большей частью серый цвет. Со свободой перемещения электронов связаны высокая электропроводность металлов и их хорошая теплопроводность. Все эти особенности резко отличают металлы от подобных алмазу и NaCl твердых вещесгв с атомной или ионной структурой. [49]
 |
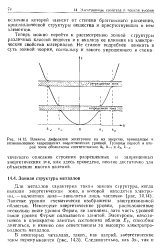
Упаковка ионов в кристалле NaCl.| Схема строения кристалла NaCl. [50] |
Наличие свободных электронов во всех металлических структурах обусловливает существование общих свойств металлов. Сюда относятся прежде всего такие характерные для них внешние признаки, как непрозрачность, металлический блеск и большей частью серый цвет. Со свободой перемещения электронов связаны высокая электропроводность металлов и их хорошая теплопроводность. Все эти особенности резко отличают металлы от подобных алмазу и NaCl твердых веществ с атомной или ионной структурой. [51]
 |
Гальванические элементы, образованные основным металлом, химически менее активным включением и электролитом ( пунктиром и стрелками показано направление тока. [52] |
Электрохимическая коррозия протекает в растворах электролитов. Механизм этого процесса связан со структурой металла и природой электролита. Наиболее существенно на процесс электрохимической коррозии влияет высокая электропроводность металлов, обусловленная наличием электронов, слабо связанных с положительными ионами, расположенными в узлах кристаллической решетки. [53]
 |
Влияние дифракции электронов на их энергию, приводящее к. [54] |
Занятые уровни схематически изображены заштрихованной областью. Некоторые энергетические уровни, расположенные несколько ниже уровня Ферми, не заселены, зато часть уровней выше уровня Ферми оказывается занятой. Электроны, находящиеся в однократно занятых состояниях вблизи EF, способны двигаться, и именно они ответственны за высокую электропроводность металлов. [55]
К ним относятся металлы, уголь, графит и электролиты: водные растворы кислот, щелочей и солей, а также соли в расплавленном состоянии. В металлах - проводниках количество свободных электронов очень велико-примерно равно числу атомов в них. Этим и объясняется высокая электропроводность металлов. В электролитах под действием растворителя происходит процесс распада молекул вещества на положительные и отрицательные ионы. От степени концентрации этих ионов зависит электропроводность того или иного электролита. [56]
В металлах и полупроводниках существует большое число электронов, находящихся на более высоких энергетических уровнях. Эти уровни составляют зону проводимости. Электроны этой зоны, называемые электронами проводимости, совершают беспорядочное движение внутри тела, переходя от одних атомов к другим. Именно электроны проводимости обеспечивают высокую электропроводность металлов. [57]
 |
Гальванический элемент, образованный основным металлом, химически менее активным включением и электролитом ( пунктиром и стрелками показано направление тока. [58] |
Электрохимическая коррозия протекает в растворах электролитов. Котловая вода, охлаждающая вода и даже конденсат содержат растворенные соли, кислород и являются слабыми электролитами. Механизм электрохимической коррозии связан со структурой металла и природой электролита. Наиболее существенно на процесс электрохимической коррозии влияет высокая электропроводность металлов, обусловленная наличием электронов, слабо связанных с положительными ионами, расположенными в узлах кристаллической решетки. [59]
Страницы: 1 2 3 4