Выделение - свободный кислород
Cтраница 1
 |
Прибор для обнаружения. [1] |
Выделение свободного кислорода растениями легко наблюдать, поставив следующий опыт. [2]
Единственным известным человеку источником выделения свободного кислорода является растительный покров земли. Организмы растений в процессе своей жизнедеятельности обладают способностью поглощать углекислоту, добывая из нее для построения ОБОИХ тканей необходимый им углерод и выделяя при этом кислород в качестве отбросного, побочного продукта, поступающего в атмосферу. В качестве труженика ( рабочего), ведущего и регулирующего эти процессы, выступает особое вещество - хлорофилл, содержащееся в растительных клетках и хорошо нам знакомое по зеленой расцветке растений. Способствуя протеканию этих процессов в тканях растений, сам хлорофилл сохраняет в конечном счете свое первоначальное состояние. [3]
Все нитраты при нагревании разлагаются с выделением свободного кислорода, вследствие чего в расплаве являются сильными окислителями. При этом нитраты щелочных металлов переходят в нитриты, а нитраты щелочноземельных и тяжелых металлов разлагаются с образованием их оксидов и диоксида азота. Нитраты малоактивных металлов с положительным электродным потенциалом, разлагаются с выделением свободных металлов и также диоксида азота. Во всех случаях протекают внутримолекулярные окислительно-восстановительные реакции. [4]
Все нитраты при нагревании разлагаются с выделением свободного кислорода, вследствие чего в расплаве являются сильными окислителями. При этом нитраты щелочных металлов переходят в нитриты, а нитраты щелочноземельных и тяжелых металлов разлагаются с образованием их оксидов и диоксида азота. [5]
Реакция гидролиза пентафторида брома протекает также с выделением свободного кислорода. В продуктах реакции обязательно содержится фтористый водород и, возможно, бромистово-дородная, бромноватистая и бромноватая кислоты. Схема гидролиза BrF5, приведенная Руффом и Менцелем [18], не совсем оправдана. [6]
Кислородная коррозия появляется во входной части экономайзера, где происходит выделение свободного кислорода. В экономайзерах кипящего типа имеет место кислородное разъедание труб выходной части, на участках, в которых происходит выпаривание воды. [7]
При повышении температуры прочность окисла понижается и происходит его диссоциация с выделением свободного кислорода. Однако диссоциация окисла происходит лишь в том случае, если давление соприкасающегося с ним кислорода в газовой фазе меньше давления кислорода, выделяющегося из окисла. Если эти давления равны, то диссоциация окисла прекратится: наступит равновесие. Наоборот, если давление кислорода в газовой фазе больше упругости кислорода, выделяющегося при диссоциации окисла, происходит окисление элемента. [8]
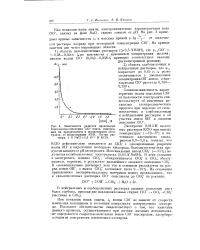 |
Зависимость разности предельных Электролиз 0 015 М щелоч. [9] |
КСЮ действительно окисляется до СЮг с одновременным разрядом ионов ОН и выделением свободного кислорода. [10]
 |
Произведение растворимости Со ( ОН2. [11] |
Закись-окись Со3О4 медленно растворяется в кислотах с образованием солей двухвалентного кобальта и выделением свободного кислорода. Растворение в соляной кислоте сопровождается выделением хлора. [12]
В противоположном случае, т.е. при роЛ: Рог - восстановление окислов с выделением свободного кислорода. Обычно в условиях сварки ро2 Ро, и характерными являются процессы окисления. [13]
Наконец, после добавления значительного количества раствора перманганата и после того, как он прореагирует с образованием ионов Мп2 и выделением свободного кислорода, можно будет наблюдать, как струя постепенно доливаемого в сосуд раствора перманганата обесцвечивается сразу после смешивания с раствором перекиси водорода. Это интересное явление объясняется тем, что продукт реакции - марганец в низшем состоянии окисления - действует как катализатор данной реакции; первая капля перманганата реагирует медленно, поскольку отсутствует катализатор, но уже следующие капли реагируют, испытывая действие - катализатора. Присутствие катализатора может быть одним из самых важных факторов, влияющих на скорость реакции. [14]
Кроме того, в покрытии могут присутствовать различные руды, содержащие высшие окислы или соединения, способные диссоциировать при нагревании с выделением свободного кислорода. Так, например, марганцевая руда ( пиролюзит) содержит МпО2, который уже при нагревании примерно до 470 переходит в форму окиси марганца Мп2О3 с выделением свободного кислорода. Дальнейший нагрев до 940 С приводит к переходу в Мп3О4, а затем в МпО с выделением свободного кислорода. [15]
Страницы: 1 2 3 4