Выделение - гидроокись - металл
Cтраница 1
Выделение гидроокисей металлов в плотной форме значительно снижает их адсорбционную способность, но сущность химической природы гидроокисей не меняется. У гидроокисей алюминия, хрома, индия и галлия, имеющих амфотерные свойства, водород гид-роксильных групп способен замещаться на тот или иной металл в зависимости от условий выделения. Таким образом, гидроокиси по своей химической природе не являются идеальной формой для группового выделения и разделения металлов. [1]
Если наблюдается выделение гидроокисей металлов, то добавляют тартраты или другие комплексообразователи с большими константами нестойкости. Затем приливают раствор соответствующего индикатора, который образует окрашенное внутрикомплексное соединение с катионами металла. Это сопровождается переменой окраски раствора в точке конца титрования. [2]
В количественном анализе аммиак применяется для выделения гидроокисей металлов третьей аналитической группы, включая наряду с катионами трехвалентных железа, алюминия и хрома также катионы бериллия, титана, урана, тория и редкоземельных металлов. [3]
В количественном анализе аммиак применяется для выделения гидроокисей металлов третьей аналитической группы: трехвалентных железа, алюминия и хрома, а также бериллия, титана, урана, тория и редкоземельных металлов. [4]
Начав работу по изучению вопроса о выделении гидроокисей металлов при помощи пиридина в одной из московских лабораторий еще в 1933 г., мы с 1935 г. широко развернули исследования в этой области на совершенно новой теоретической основе. [5]
Применение слабого органического основания - пиридина [12, 13] для выделения гидроокисей металлов позволило очень точно регулировать величину рН раствора и выделять гидроокиси в плотной форме, обладающей малой адсорбционной способностью. С марганцем, никелем, кобальтом и цинком пиридин образует легкорастворимые, достаточно прочные комплексные соединения. Морачевский и Башун [14], изучая разделение металлов третьей аналитической группы, провели сравнительное исследование аммиачного, ацетатного и пиридинового методов, осуществляя контроль разделения при помощи радиоактивных изотопов. По данным, полученным авторами, пиридиновый метод дает наиболее полное разделение. [6]
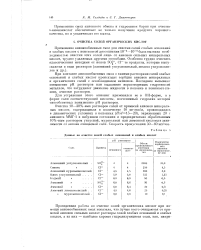 |
Данные по очистке солей слабых оснований и слабых кислот. [7] |
При контакте анионообменных смол с такими растворами солей слабых оснований и слабых кислот происходит сорбция анионов минеральных и органических солей с освобождением катионов. Последние вызывают повышение рН растворов или выделение нерастворимых гидроокисей металлов, что затрудняет движение жидкости в колонке и понижает степень очистки растворов. [8]
Над вопросом изменения рН среды при выделении гидроокиси одного и того же металла из растворов различных солей работали Гильдебранд [1] и Бриттон [2, 3], причем они пришли к противоположным выводам. Гильдебранд, работавший с солями неодима, нашел, что рН среды при выделении гидроокиси металла зависит от состава соли; Бриттон же в своей работе [4] не подтвердил выводов Гильдебранда. [9]
Над вопросом изменения рН среды при выделении гидроокиси одного и того же металла из растворов различных солей работали Гильдебранд [1] и Бриттон [2, 3], причем они пришли к противоположным выводам. Гильдебранд, работавший с солями неодима, нашел, что рН среды при выделении гидроокиси металла зависит от состава соли; Бриттон же в своей работе [4] не подтвердил выводов Гильдебранда. [10]
Однако эти соединения сравнительно легко гидролизуются и получить их в совершенно чистом впде довольно трудно. Растворение аммиакатов и амипатов в воде, особенно при нагревании, обычно вызывает их постепенное разложение с выделением гидроокисей металлов п аммиака или соответствующего амипа. Поэтому перекристаллизация соединений, за редким исключением, возможна только из растворов, содержащих избыток веществ, входящих в состав комплекса. [11]
Из кривых титрования ( рис. 7, 8 и 9) ясно видно, что при проведении комплексонометрических титрований следует тщательно подбирать условия определений. Это выгодно лишь при титровании щелочноземельных металлов. При титровании ионов тяжелых металлов прибавленное в составе буферного раствора вещество основного характера ( МНз) связывает в комплекс титруемый металл, вследствие чего начальная ветвь кривой титрования располагается выше и скачок рМ в точке эквивалентности ( при а 1) уменьшается. Даже при наличии акцептора протонов, не имеющего сродства к титруемому иону металла, невозможно существенное увеличение скачка рМ, так как в этом случае при повышении рН к ионам металла присоединяются ионы гидроксила до тех пор, пока не наступает выделение гидроокиси металла. Теоретически лучшими веществами для буферных растворов являются те, которые почти не образуют комплексов с металлом и предотвращают выпадение осадка гидроокиси. Таким требованиям лишь в какой-то степени отвечают аммиак и различные органические амины. Поэтому практические возможности комплексонометрии узко ограниченны. [12]
Величину рН среды рекомендуется регулировать добавкой кислоты или щелочи. После перемешивания мешалкой в смесительной камере образуются хлопья гидроокиси металла. Затем при поступлении сточных вод в отстойник рекомендуется опять регулировать величину рН кислотой или щелочью до значений, при которых гидроокись металла растворяется. При этом тяжелые частицы загрязнений оседают, а мелкие всплывают. Из отстойника сточные воды направляются во вторую смесительную камеру, обору-дованную мешалкой. Затем сточные воды снова подкисляются или подщелачиваются с целью выделения гидроокиси металла, хлопья которых с адсорбированными на них ПАВ отделяются во флотационном резервуаре. Флотация происходит с помощью пузырьков газа, образующихся при электролизе в результате пропуска постоянного электрического тока. Всплывающие загрязнения собираются и обрабатываются серной кислотой, что позволяет получить сульфаты для повторного использования. Осветленные таким образом сточные воды содержат около 60 мг / л веществ, экстрагируемых эфиром. [13]
Железо, хром, никель и другие металлы-сравнительно слабые комплексообразователи. Характерной особенностью комплексных соединений этих элементов является то, что при замещении во внутренней сфере одних групп другими почти совсем не образуется промежуточных соединений, принадлежащих к так называемым переходным рядам. Так, при получении аммиакатов, аминатов и других соединений, как правило, образуются продукты полного замещения. Однако эти соединения сравнительно легко гидролизуются и получить их в совершенно чистом виде довольно трудно. Растворение аммиакатов и аминатов в воде, особенно при нагревании, вызывает обычно их постепенное разложение с выделением гидроокисей металлов и аммиака или соответствующего амина. [14]
Страницы: 1