Электролитическое выделение - металл
Cтраница 3
Сплавообразование при электролитическом выделении металлов из водных растворов обнаружено давно. [31]
Все рассмотренные случаи электролитического выделения металла интерпретированы с точки зрения кристаллохимической теории электрс-кристаллизации и объединены условием минимума перенапряжения электрокристаллизации, являющимся руководящим при анализе явлений выделений металла при электролизе. [32]
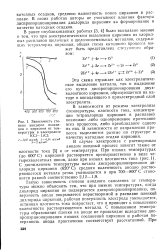
Для выяснения механизма электролитического выделения металлов весьма важно точно установить величину поляризации для каждой плотности тока. [33]
 |
Схема прибора А. Т. Ваирамяна. [34] |
Для выяснения механизма электролитического выделения металлов А. Т. Ваграмян разработал метод, позволяющий пренебречь изменениями поверхности электрода во время электролиза. [35]
Шекой была выпущена монография Электролитическое выделение металлов из неводных растворов - единственное до настоящего времени обобщение в мировой литературе, посвященное названной проблеме. Сегодня исследования теоретических и прикладных аспектов неводной гальваники ведутся у нас в стране достаточно широко. [36]
 |
Зависимость сте. [37] |
Эта схема отражает как электролитическое выделение металла, так и выделение его путем диспропорционирования двухвалентного циркония, образующегося на катоде и попадающего в приэлектродный слой электролита. [38]
Шекой была выпущена монография Электролитическое выделение металлов из неводных растворов - единственное до настоящего времени обобщение в мировой литературе, - посвященное названной проблеме. Сегодня исследования теоретических и прикладных аспектов неводной гальваники ведутся у нас в стране достаточно широко. [39]
 |
Термогравиметрическая кривая оксалата кальция. [40] |
Электрогравиметрический анализ основан на электролитическом выделении металлов и взвешивании полученного на электроде осадка металлов. Первое требование к осадкам в гравиметрическом анализе - их практическая нерастворимость - хорошо выполняется в электроанализе, так как большинство металлов не растворяется в воде. Однако электролитическое осаждение иногда бывает неполным вследствие преждевременного прекращения электролиза. При электролизе осаждение происходит только в момент приближения определяемых ионов к поверхности электрода, поэтому очень большое значение имеет перемешивание раствора. [41]
Сущность метода заключается в электролитическом выделении металла или его оксида на электроде и определении массы полученного осадка. Поскольку ток не измеряют, а требуется только специфичность реакции электролитического выделения металла, электролиз обычно проводят при контролируемом потенциале. Таким образом, метод сочетает в себе принципы весового анализа, т.е. гравиметрии, и потенциостатической кулонометрии. В наиболее простых случаях, например при выделении меди из раствора, не содержащего других ионов, условия электролиза не контролируют и его проводят при постоянном токе. Если параллельно с выделением металла протекают другие электрохимические реакции, которые не сопровождаются выделением осадка, они не мешают определению, так как растворенные и газообразные продукты не изменяют массу осадка на электроде. [42]
 |
Схема процесса электролиза. [43] |
Характер катодных осадков при электролитическом выделении металлов зависит как от индивидуальных особенностей металлов, так и от состава раствора и условий электролиза. Некоторые металлы, например никель, цинк, кобальт, образуют равномерные плотные мелкозернистые осадки почти независимо от природы электролита. [44]
Для каких целей при электролитическом выделении металлов вводят комплексообразователи. [45]
Страницы: 1 2 3 4