Электролитическое выделение - никель
Cтраница 1
Электролитическое выделение никеля и других металлов группы железа сопровождается значительной анодной и катодной поляризацией. В сильнокислых средах выделение никеля на катоде почти невозможно, поскольку на нем выделяется почти один нодород. В растворах с небольшой кислотностью, близких к iicii - ральным, изменение рН резко сказывается на работе электролита, причем изменяются как свойства никелевых осадков, так и выход металла по току. Чрезвычайно важную роль играет также режим работы никелевых электролитов, так как катодная плотность тока, температура электролита и перемешивание значительно влияют на величину поляризации и на структуру осаждаемых никелевых осадков. Значение рН электролита, концентрация никеля и режим никелирования должны быть тесно увязаны друг с другом. Определяя оптимальную кислотность никелевого электролита, необходимо учитывать два обстоятельства: 1) при недостаточном содержании ионов водорода в электролите ( рН выше 6 3) образуется гидроокись никеля и осадки делаются темными; 2) при уменьшении значения рН электролита ( ниже 4) количество водорода, выделившегося на катоде, будет значительно увеличиваться, гак как потенциал никеля электроотрицательнее потенциала водорода, что вызовет резкое снижение выхода металла по току и ухудшит сцепление осадка с покрываемой поверхностью. [1]
Электролитическое выделение никеля из растворов его хлористой соли, Отч. [2]
При электролитическом выделении никеля из раствора 1 г сплава, содержащего 9 63 % никеля, в течение 360 мин при токе 1 5 а в выделенном металле в виде примеси оказался кобальт. [3]
Какое значение имеет электролитическое выделение никеля в технике. [4]
После выделения никеля электролит поступает на вторичную переработку, в результате которой из него дополнительно извлекается никель, а также кобальт и медь. Очищенный электролит вновь поступает в цех электролитического выделения никеля. [5]
Мешает медь, которую можно отделить сначала электролизом из раствора, содержащего серную и азотную кислоты. После этого надо раствор выпарить до появления белых паров серной кислоты, чтобы удалить нитрат-ионы, замедляющие электролитическое выделение никеля. [6]
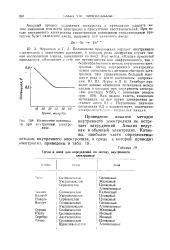 |
Изменение потенциала при внутреннем электролизе. [7] |
Как можно видеть, изменение потенциала за все время электролиза достигает всего 0 1 с. Постоянное значение потенциала 0 5 в соответствует окончанию электролитического выделения никеля. [8]
От величины рН раствора может зависеть, будет ли определяемый металл полностью выделен на электроде. При работе с такими легко восстанавливающимися веществами, как ионы меди ( II) или серебра ( I), которые можно без труда количественно выделить в очень кислой среде, не возникает никаких проблем. При осаждении менее легко восстанавливающихся элементов из кислого раствора одновременно выделяется водород, поэтому, например, для электролитического выделения никеля или кадмия требуется нейтральная или щелочная среда. [9]
 |
Изменение потенциала при внутреннем электро. [10] |
Этот метод, обладая простотой выполнения, объединяет в себе все преимущества как диафрагменного, так и бездиафрагменного метода внутреннего электролиза. Как можно видеть, изменение потенциала за все время электролиза достигает всего 0 1 в. Постоянное значение потенциала 0 5 в соответствует окончанию электролитического выделения никеля. [11]
Из хлорида железа с помощьк пара получают окислы. Прежде всего экстрагируют медь. Рафинат снова вводят в контакт с Kelex 100 при рН 3J для экстракции кобальта и никеля. Эти металлы разделяют в результате реэкстракции никеля отработанным электролитом и; ванн электролитического выделения никеля. [12]
Первые два момента являются преимуществами внутреннего электролиза без диафрагмы, последние два - его недостатком. Чернихов и Большакова предложили вариант внутреннего электролиза с защитными пленками, в кото, ром роль диафрагмы играет тонкая коллодийная пленка, нанесенная на анод. Этот метод, обладая простотой выполнения, объединяет в себе все преимущества как диафрагменного, так и без-диафрагменного метода внутреннего электролиза. Метод внутреннего электролиза может быть сравнен с методом обычного электролиза при сравнительно большой плотности тока и почти постоянном напряжении. Как видим, изменение потенциала за все время электролиза достигает всего 0 1 в. Постоянное значение потенциала 0 5 в соответствует окончанию электролитического выделения никеля. [13]
Страницы: 1