Выживаемость - мышь
Cтраница 1
Выживаемость мышей при рентгеновском облучении в дозах 5 и 6 Гр повышается при подкожном введении апи-лита за 24 ч до облучения. Апилит выделен из пчелиного яда, он содержит несколько полипептидов, из которых наиболее важным является мелитин, состоящий из 26 аминокислот. Препарат обладает и терапевтическим эффектом после облучения [ Артемов и соавт. [1]
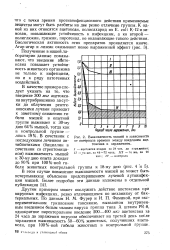 |
Выживаемость мышей в зависимости от интервала времени между введением ацетоксана и заражением. [2] |
В этом случае повышение выживаемости мышей не может быть исчерпывающе объяснено предотвращением лучевой аутоинфекции мышей. [3]
Кроме того, эти результаты фактически противоречили более ранним сообщениям Джекобсона, наблюдавшего соответствие между выживаемостью облученных мышей и имплантацией селезенки. [4]
При этом в случае введения гипорамина за 5 часов до инфицирования наблюдалось, кроме того, увеличение выживаемости мышей на 31 % при полной их гибели в контроле. Подобный эффект ( гибель животных в более поздние сроки по сравнению с контрольной группой) отмечен и для другой опытной группы, в которой для инфицирования использовали более высокую дозу патогенного вируса - 100 ЛДзо. При этом в группе, где гипорамин вводили за 5 часов до инфицирования, гибель животных начиналась на 3 суток позже, чем в контроле, а в группе, где препарат применяли за 1 час до заражения - на 1 сутки позже, чем в контроле. Таким образом, полученный нами в данном опыте результат свидетельствует о том, что в большинстве опытных групп мышей, получавших гипорамин, гибель животных наблюдалась в более поздние сроки, чем в контрольных группах, а в одной группе отмечено увеличение выживаемости животных в сравнении с контрольной. [5]
Как видно из рисунка ( б), существует прямая связь между константой устойчивости и вкладом комплексообразования изученных соединений в эффект выживаемости облученных мышей. [6]
В экспериментах Ро-гозкина ( 1960) совместное пероральное повторное введение аскорбиновой кислоты ( 50 - 100 мг / кг) и витамина Р, выделенного из листьев чая ( 10 - 20 мг / кг), в течение 7 - 10 сут приводило к повышению выживаемости мышей на 20 % при общем облучении животных в дозе 5 Гр. [7]
Другим неспецифическим средством, довольно эффективно детоксирующим змеиный яд, является трипсин. Увеличение интервала до 50 мин снижало выживаемость мышей на 50 % - В опытах на собаках защитный эффект трипсина наблюдался и при его введении на расстоянии 1 - 2 см от места инъекции яда. [8]
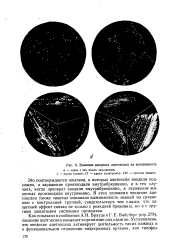 |
Влияние введения ацетоксана на высеваемость. [9] |
Это подтверждается опытами, в которых ацетоксан вводили подкожно, а заражение производили внутрибрюшинно, и в тех случаях, когда препарат вводили внутрибрюшинно, а заражение животных производили внутривенно. В этих условиях введение ацетоксана также заметно повышало выживаемость мышей по сравнению с контрольной группой, свидетельствуя тем самым, что защитный эффект связан не только с реакцией брюшины, но и с другими защитными системами организма. [10]
Не вызывает сомнений, что истощение внутриклеточного фонда свободных нуклеотидов играет существенную роль в снижении жизнеспособности облученных клеток и организма в целом. Показательно, что внутрибрюшинное введение оротовой кислоты или оротата калия в дозе 15 мг / кг за 1 ч до v-облучения в дозе 7 5 или 8 0 Гр повышает выживаемость мышей на 70 % и среднюю продолжительность жизни погибающих после облучения животных на 17 сут. Радиозащитное действие этих соединений проявляется и при внутри-желудочном введении их с питьевой водой в течение 12 сут в дозе около 0 3 мг в сутки [ Кожокару А. [11]
При одновременном введении животным комбинаций радиопротекторов было обнаружено, что в одних случаях радиозащитный эффект двух соединений не превышал эффекта каждого из них в отдельности, а в других комбинация р-меркаптоэтиламина ( МЭА) с серотонином, МЭА с гистамином и трианизилхлорэтилена с серото-нином наблюдался аддитивный эффект. Это позволило предположить, что радиозащитное действие радиопротекторов иногда реализуется через различные рецепторные образования. Используя блокаторы ( 3-адренорецепторов, удалось значительно уменьшить противолучевое действие S - p - аминоэтилизотиурония ( АЭТ), трианизилхлорэтилена и парааминопропиофенона ( ПАПФ), но не серотонина. Кофеин ( ингибитор фосфодиэстеразы) сам по себе не влиял на выживаемость облученных мышей, но значительно усиливал ( с 22 до 53 %) противолучевые свойства АЭТ. [12]
Оно вводится людям в дозах 100 и 500 мг перорально или внутривенно. Каких-либо побочных эффектов не отмечается. В опытах на мышах оптимальная внутрибрюшинная защитная доза составляет 20 мг / кг. Терапевтический индекс высок, поскольку внутрибрюшинная токсическая доза МПГ у мышей по ЛД5о составляет 1400 мг / кг. В своих опытах мы при оценке выживаемости мышей при летальных дозах тотального гамма-облучения [ Кипа, Jary, 1982 ] не подтвердили защитного действия МПГ, вводимого внут-рибрюшинно в дозе 25 мг / кг. [13]
Страницы: 1