Вычисление - изменение - энтропия
Cтраница 2
Эти соотношения применяются в вычислениях изменения энтропии при приведении газа к стандартным условиям. [16]
Применение энтропийного принципа предполагает принципиальную возможность вычисления изменения энтропии каждого из участников процесса. Подобное вычисление возможно только в том случае, если переход системы из начального состояния в конечное осуществим квазистатическим путем. [17]
Этим тепловым эффектам отвечают определенные изменения энтропии, которые и нужно учитывать при вычислении изменения энтропии реакции. [18]
Энтропия измеряется в единицах Дж / град. Вычисление изменения энтропии во многих случаях проводится очень просто. [19]
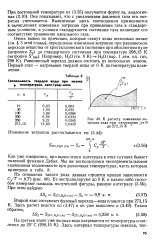 |
К расчету изменения энтропии льда при нагревании от О1 до 273 15 К. [20] |
Она показывает, что с увеличением давления газа его энтропия уменьшается. Выведенные здесь соотношения применяются в вычислениях изменения энтропии при приведении газа к стандартным условиям, а условия стандартности состояния газа включают его соответствие уравнению идеального газа. [21]
Она показывает, что с увеличением давления газа его энтропия уменьшается. Выведенные здесь соотношения применяются в вычислениях изменения энтропии при приведении газа к стандартным условиям, а условия стандартности состояния газа включают его соответствие уравнению идеального газа. Очень важно по причинам, которые станут ясны несколько позже ( см. § 5 этой главы), определение изменения энтропии при равновесном переходе вещества от кристаллического-состояния при абсолютном нуле ( энтропия S0) до стандартного состояния при температуре 298 15 К ( энтропия S & s) - Например, Н2О ( тв 0 К) - Н2О ( пар, 1 атм, ид. [22]
В настоящей главе читатель получил представление об одном из наиболее трудных понятий классической термодинамики равновесных процессов, а именно об энтропии как одной из термодинамических характеристик системы. Установив, что ключом к энтропии как характеристики является первая теорема об обратимой работе ( разд. Затем мы обсудили вопрос о том, имеет ли смысл изменение энтропии системы, если ее состояние изменяется в результате необратимого процесса. При этом было установлено, что для идентифицируемых начального и конечного устойчивых состояний вычисление изменения энтропии в процессе необратимого перехода вполне осмысленно, и его следует проводить путем использования альтернативного обратимого процесса перехода между теми же состояниями. [23]
Для твердого водорода остаточная энтропия при О К обусловливается существованием двух его модификаций: пара - и орто-водорода. Так как атомы С и О близки по своим размерам, то эти два вида ориентации в кристалле должны обладать практически одинаковой энергией. Сравнение значений стандартной энтропии СО, вычисленных на основании калориметрических измерений [ 193 3 Дж / ( моль К) 1 и спектроскопических данных [ 197 99 Дж / ( моль К) ], подтверждает этот вывод. Кроме того, если учесть, что при термодинамических расчетах оперируем изменением энтропии при протекании процесса, то эти ошибки в значениях энтропии могут взаимно погашаться. Почти каждый химический элемент представляет собой смесь изотопов. Смешение изотопов, как и образование твердых растворов, ведет к появлению остаточной энтропии. Остаточная энтропия связана с ядерными спинами. Если учесть, что при протекании обычных химических реакции не изменяется изотопный состав системы, а также спины ядер, то остаточными составляющими энтропии при вычислении изменения энтропии ДГ5 можно пренебречь. [24]
Для твердого водорода остаточная энтропия при О К обусловливается существованием двух его модификаций: пара - и орто-водорода. Так как атомы С и О близки по своим размерам, то эти два вида ориентации в кристалле должны обладать практически одинаковой энергией. Сравнение значений стандартной энтропии СО, вычисленных на основании калориметрических измерений [ 193 3 Дж / ( моль К) 1 и спектроскопических данных [ 197 99 Дж / ( моль К) 1, подтверждает этот вывод. Кроме того, если учесть, что при термодинамических расчетах оперируем изменением энтропии при протекании процесса, то эти ошибки в значениях энтропии могут взаимно погашаться. Почти каждый химический элемент представляет собой смесь изотопов. Смешение изотопов, как и образование твердых растворов, ведет к появлению остаточной энтропии. Остаточная энтропия связана с ядерными спинами. Если учесть, что при протекании обычных химических реакций не изменяется изотопный состав системы, а также спины ядер, то остаточными составляющими энтропии при вычислении изменения энтропии & rS можно пренебречь. [25]
Страницы: 1 2