Вязкость - водород
Cтраница 2
В табл. 4.8 приведены значения вязкости нормального жидкого и газообразного водорода в характерных точках. Вязкость водорода при температуре плавления и в критической точке определены наименее точно. [16]
Вязкость углекислого газа и вязкость тяжелых углеводородов, кроме метана, мало отличаются одна от другой и приблизительно равны половине вязкости газов первой группы. Вязкость водорода приблизительно в 7 раз больше вязкости газов первой группы. [17]
Вязкость углекислого газа и вязкость тяжелых углеводородов, кроме метана, мало4 отличаются одна от другой и приблизительно равны половине вязкости газов первой группы. Вязкость водорода приблизительно в 7 раз больше вязкости газов первой группы. [18]
В последнее время большое внимание уделяется изучению подоро-да как наиболее перспективного авиационного топлива. Данная работа посвящена нахождению коэффициента вязкости водорода в жидкой л газообразной фазе. [19]
В опытах с аргоном была применена другая экспериментальная трубка. Ввиду того, что вязкость аргона значительно меньше вязкости водорода и гелия, диаметр трубки был уменьшен до 8 мм. Уменьшение диаметра повлекло за собой изменение конструкции, так как сборка нити на вставляющемся каркасе стала невозможной. [20]
Из-за малой плотности водорода нормальные сужающие устройства при минимальном диаметре трубопровода 50 мм можно применять при расходах более 200 - 300 м3 / ч ( здесь и далее при нормальных условиях) или линейных скоростях 40 м / сек и выше. Большие расхождения между определением расхода водорода расчетом по перепаду давления на диафрагме и фактическим расходом возникают вследствие недостаточного учета свойств реального газа ( особенно зависимости плотности и вязкости водорода от влажности и примесей инертных газов) при расчете диафрагм и пересчете показаний дифманометра в объемный расход. [21]
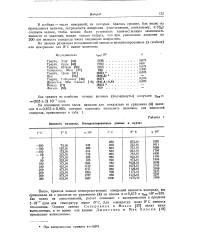 |
Вязкость водорода. Интерполированные данные в пуазах. [22] |
В скобках - число измерений, из которых бралось среднее. Как видно из ( Приведенных величин, погрешности измерения ( достигающие, повидимому, 5 %) слишком велики, чтобы можно было установить количественную зависимость вязкости от давления, можно только сказать, что при увеличении давления до 200 am вязкость водорода имеет тенденцию возрастать. [23]
Уравнение (4.11) описывает одновременно как жидкую, так и газовую фазы, а также обе ветви линии насыщения. Уравнение (4.11) допускает надежную экстраполяцию вверх по температуре до 900 - 1300 К. Вязкость водорода можно определять графически. В координатах [ рр, г / ( Хр, т - И-о) ] - РР, т все опытные изотермы сжатого газа и жидкостей имеют вид параллельных прямых линий в диапазоне от ркр до р Зркр. [24]
В табл. 1 приведены некоторые данные для этана, полученные при введении чистого газа ( 1 мл) в различные колонки. Как видно из таблицы, несмотря на значительное изменение концентрации компонента в газе-носителе, поправкой на эффект поднятия можно пренебречь. Поскольку вязкость водорода и этана очень близка, то эффект вязкости в этом случае также не принимается во внимание. [25]
Формула (2.3), рекомендуемая для расчета вязкости газов с неполярными молекулами, может быть использована для расчета вязкости таких полярных соединений, как диоксид серы и аммиак, с довольно высокой точностью. С меньшей погрешностью рассчитываются вязкость водорода, гелия, хлора и хлорида водорода. Точность рассчитанной вязкости по формуле (2.8) для всех газов ниже, чем по предыдущим формулам. Особо низкая точность достигается для благородных газов, хлорида водорода и сероводорода. Формула (2.9) обеспечивает наиболее высокую точность расчета вязкости всех газов, кроме хлора. По формуле (2.10) с низкой точностью рассчитывается вязкость фтора, хлора и сероводорода. При расчете по формуле (2.11) получаются результаты с большими погрешностями для водорода, неона, воздуха, гелия, хлора, сероводорода, оксида азота. Формула (2.12) - наименее точная из всех формул для расчета вязкости газов. [26]
Электростатические заряды образуются также при перемешивании жидкого водорода. Накопление зарядов происходит в основном в результате адсорбции ионов на поверхности стенок трубопроводов. Величина накапливаемого электрического заряда зависит в основном от электрической проводимости, вязкости водорода, скорости его потока, содержания в нем примесей. [27]
До настоящего времени работ, посвященных измерению вязкости воздуха и двуокиси углерода при высоких давлениях и температурах выше 200 - 250 С, не было опубликовано. Для других веществ подобных измерений проводилось очень мало. Можно указать на нашу работу, в которой приводятся экспериментальные данные по вязкости водорода в пределах температур 100 - 791 С и по вязкости азота для 200 - 600 С при давлениях до 500 кг / см2, определенные методом капилляра. [28]
Изучению вязкости газов при различных температурах и при обычных плотностях посвящено значительное число работ. Простая теория вязкости, основанная на кинетической теории газов 355 35, говорит, что вязкость не должна зависеть от плотности. Майкельс и Гибсон ( Michels и Gibson) 35T измеряли вязкость азота при 25, 50 и 75 С и при давлениях до 1000 ат. Бойд ( Boyd) S5S опубликовал данные по вязкости водорода, азота и смеси этих газов при различных температурах и давлениях до 200 ат. Варбург и фон - Бабо 359, а также Филлипс ( Phillips) seo определяли вязкость углекислоты при давлениях выше 100 аг. Как Варбург, так и фон - Бабо и Филлипс, пользуясь методом транспирации, пренебрегали некоторыми поправками, возникающими вследствие того, что газ расширяется внутри капилляра благодаря падению давления и что до того, как течение газа делается ламинарным ( безвихревым), создается добавочное трение. Бриллуэн ( Brillouin, Lecons sur la viscosite des fluides, 1907) внес поправки в результаты, полученные Варбургом и Бабо. Недавно Невитт и Сиркар ( Nevitt и Sirkar) 3ei измерили фрикционное сопротивление течению азота, водорода, водородо-азотной смеси 3: 1, углекислоты и других газов через трубки диаметром от 0 08 до 3 мм. [29]
Гелий в жидком состоянии образует две разновидности: гелий I и гелий II. Гелий I существует при температурах выше 2 172 К, а гелий II - при температурах ниже этой точки. Переход модификации I в II сопровождается аномалиями в ходе теплоемкости и других свойств. Гелий II - удивительное вещество: он сверхтекуч - его вязкость в 10 1 раз меньше вязкости водорода в газообразном состоянии, теплопроводность в 3 - Ю6 раз больше, чем у гелия I. В результате слабовыраженных сил межатомного взаимодействия гелий остается жидким при столь низких температурах ( около 2 К), при которых межатомные расстояния сравнимы с длиной волны де Бройля. Поэтому гелий следует квантовым законам ( квантовая жидкость), ведет себя иначе, чем обычные жидкости. [30]
Страницы: 1 2