Отрицательно заряженный ион
Cтраница 3
Положительно и отрицательно заряженные ионы вследствие возникающего между ними электростатического притяжения образуют химическое соединение. [31]
 |
Схема влияния на поляризацию отрицательных ионов. [32] |
Напротив, отрицательно заряженные ионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, к ослаблению их связи с ядром. По этим причинам поляризуемость анионов, как правило, значительно выше поляризуемости катионов. [33]
 |
Схема влияния на поляризацию отрицательных ионов. [34] |
Напротив, отрицательно заряженные ионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, к ослаблению их связи с ядром. По этим причинам поляризуемость анионов, как правило, значительно выше поляризуемости катионов. [35]
На аноде отрицательно заряженные ионы иода притягиваются к нему и, отдавая свои электроны, превращаются в молекулярный иод. [36]
На аноде отрицательно заряженные ионы иода притягиваются к нему и, отдавая свои электроды, превращаются в молекулярный иод. [37]
Как образуются отрицательно заряженные ионы галогенов и чем объясняется то, что они имеют только один отрицательный заряд. [38]
Восстановительная способность отрицательно заряженных ионов при одинаковой величине заряда растет с увеличением радиуса атома. Поэтому, например, в группе галогенов ион 1 - обладает большей восстановительной способностью, чем ионы Вг - и Cl -, a F - восстановительных свойств совсем не проявляет. [39]
Восстановительная способность отрицательно заряженных ионов при одинаковом заряде растет с увеличением радиуса атома. [40]
В виде отрицательно заряженных ионов Э - они и встречаются в природе. Галогены образуют однотипные газообразные соединения с водородом НЭ и с металлами МеЭх, где х - валентность металла. Таким образом, галогены являются типичными неметаллами. [41]
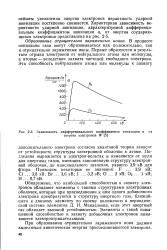 |
Зависимость дифференциального коэффициента ионизации а от. [42] |
При образовании отрицательно заряженного иона должна выделиться кинетическая энергия присоединившегося электрона. [43]
Образование простых отрицательно заряженных ионов, напротив, характерно для атомов типичных неметаллов, обладающих большим сродством к электрону. [44]
В становится отрицательно заряженным ионом, заменяющим атом Si в кристаллической решетке. Энергия ионизации ( энергия, необходимая для отрыва дырки от отрицательного иона В) равна примерно 0 008 адж и при обычной температуре все трехвалентные примесные атомы оказываются ионизированными, а дырки участвуют в процессе электропроводности. Поэтому, если в кристалле Si имеется примесь трехвалентных атомов ( III группа периодической системы), то электропроводность осуществляется в основном дырками; происходит дырочная ( положительная) электропроводность, или электропроводность р - типа. Примеси, вызывающие дырочную электропроводность, называют акцепторными. [45]
Страницы: 1 2 3 4