Активация - аминокислота
Cтраница 2
Указанная реакция, а следовательно, и суммарная реакция оказывается сильно сдвинутой вправо, в сторону синтеза аминоациладенилата и аминоацил-т РНК, благодаря протеканию реакции гидролиза неорганического пирофосфата, катализируемой пирофосфатазой. Таким образом, тот факт, что в результате реакции активации аминокислоты освобождается пирофосфат, далее гидролизуемый до неорганического орто-фосфата, играет важную роль в энергетическом обеспечении направленности всего процесса. [16]
Здесь следует упомянуть о работах, посвященных механизму синтеза полипептидов. Как предполагается в этих работах, первая стадия переноса аминокислотного остатка к РНК-переносчику заключается в активации аминокислоты при реакции с АТФ. [17]
Информационные РНК служат матрицамтгдля синтеза различных белковых молекул. Перевод генетической информации с языка нуклеотидов на язык аминокислот - сложный многостадийный процесс, включающий активацию аминокислот, образование ими комплексов с особым видом РНК ( транспортными РНК, или тРНК), взаимодействие этих комплексов с иРНК, связанной с рибосомой, приводящее в конечном итоге к формированию полипептидной цепи, аминокислотный состав которой изначально запрограммирован в определенном участке ДНК. В осуществлении каждой из стадий, ведущих к синтезу молекулы белка, участвует несколько различных ферментов. [18]
Есть данные, что активность бластицидина состоит в передаче аминокислоты протеину микросом. Доказательством является тот факт, что бластицидин ингибирует передачу С14 аминокислоты рибосомам, но яе активацией аминокислоты и передачей С-аминокислоты растворимой РНК. Это же подтверждает и тот факт, что бластицидин повреждает те растения риса, которые содержат большое количество протеинов РНК. Бластицидин аккумулиру-ет и физические, и химические свойства природной РНК. [19]
Синтез белка представляет собой циклический энергозависимый многоступенчатый процесс, в котором свободные аминокислоты полимеризуются в генетически детерминированную последовательность с образованием полипептидов. В табл. 14.1 обобщены известные к настоящему времени данные о составе белоксинтезирующей системы у про - и эукариот в каждой из 5 стадий синтеза, из которых 3 стадии ( инициация, элонгация и терминация) по аналогии со стадиями синтеза полимерных молекул ДНК и РНК ( см. главу 13) считаются главными и основными, а 2 стадии ( активация аминокислот и постсинтетический процессинг) рассматриваются в качестве дополнительных, вспомогательных стадий синтеза. Более 100 макромолекул участвует в активировании аминокислот и их переносе на рибосомы ( все тРНК, аминоацил-т РНК-синтетазы), более 60 макромолекул входит в состав 70S и 80S рибосом, и около 10 макромолекул, называемых белковыми факторами, принимающих непосредственное участие в системе трансляции. Не разбирая подробно природу других важных для синтеза факторов, рассмотрим механизм индивидуальных путей синтеза белковой молекулы в искусственной синтезирующей системе. [20]
Легко подсчитать число макроэргов, которые расходуются на образование одной полипептидной связи. При активации аминокислот АТФ гидролизуется до АМФ, что эквивалентно затрате двух макроэргов, а инициация трансляции требует один макроэрг ГТФ. В процессе элонгации затрачивается два макроэрга ГТФ: один на доставку аминоацил-т РНК в А-центр рибосомы, а второй - на процесс транслокации. И наконец, на терминацию требуется один макро-эрг ГТФ. [21]
 |
Применение гидролитических ферментов при производстве аминокис. [22] |
Они катализируют множество реакций: рацемизацию, трансаминирова-ние, декарбоксилирование, реакции замещения и элиминации и являются своего рода универсальными. По-видимому, роль этих коферментов состоит в активации аминокислот, что облегчает их взаимодействие с апоферментом. Мы рассмотрим здесь лишь несколько ферментов из этой группы. Так, L-тирозин - фенол-лиаза ( р-тирозиназа) катализирует реакцию р-элимина-ции, в которой тирозин распадается с образованием пируватаг фенола и аммиака. [23]
Возможность включения отдельных аминокислот в белки была впервые показана после того, как в биохимических исследованиях стали применять аминокислоты, меченные радиоактивным углеродом, тяжелым азотом или радиоактивной серой. Механизм этого процесса тесно связан с биосинтезом белка заново. Аминокислоты перед включением в белок должны быть активированы. Активация аминокислот осуществляется под действием АТФ с образованием аденилатов аминокислот. Включение аминокислот в белки тесно связано с нуклеиновыми кислотами. [24]
Активирование аминокислот на первом этапе биосинтеза приводит к тому, что молекулы их становятся гораздо более активными, более реакционноспособны-ми, что облегчает взаимодействие их друг с другом. В лабораторных условиях, для того чтобы соединить аминокислоты друг с другом, химик должен предварительно активировать их по линии либо карбоксильной, либо аминной группы введением какого-нибудь радикала. Только после этого аминокислоты могут взаимодействовать друг с другом. В организме активация аминокислот происходит иными, более мягкими путями, чем это обычно делает химик. В некоторой степени это вещество нам уже известно, так как это один из обычных нуклеотидов - адениловая кислота ( см. стр. [25]
Далее, по мере изучения этих явлений стало очевидным, что определенные ферменты активируют определенную аминокислоту. Другими словами, для активирования каждой отдельной аминокислоты требуется свой особый специальный фермент. Подобные ферменты активирования аминокислот были обнаружены в препаратах ( рН5 - фракция) из дрожжей и бактерий, а затем были найдены во всех изучавшихся тканях животных и растений. Таким образом, активация аминокислот во всем органическом мире, видимо, осуществляется одними и теми же способами. [26]
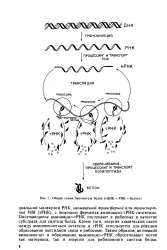 |
Общая схема биосинтеза белка ( ДНК - РНК - белок. [27] |
Получающиеся аминоацил-т РНК поступают в рибосому в качестве субстрата для синтеза белка. Кроме того, энергия химической связи между аминокислотным остатком и тРНК используется для реакции образования пептидной связи в рибосоме. Таким образом, активация аминокислот и образование - аминоацил-т РНК обеспечивают поток как материала, так и энергии для рибосомного синтеза белка. [28]
В 1957 г. Крик [ 37а ] предположил, что для расположения аминокислот в ряд, соответствующий расположению их кодонов в транскрибированной РНК, необходимы специальные адапторные молекулы. Крик считал, что адаптерами могут служить полинуклеотиды. К тому времени в результате химических исследований клеточной РНК было обнаружено, что в клетках на долю РНК с низким молекулярным ве - j сом приходится до 15 % общего количества РНК. В том же году ( 1957) открытие Хоглендом ферментативной активации аминокислот перед их включением в состав белка позволило предположить, что молекулы именно этой низкомолекулярной РНК играют роль постулированных адаптеров. [29]
Функция рибосом состоит, надо полагать, в удержании и - РНК в развернутом состоянии, чтобы все ее кодоны были легко доступны и и - РНК могла бы осуществить свои функции, как матрица. Цепь и - РНК одновременно связывается с несколькими рибосомами, образуя активный структурный элемент для синтеза белка - полисому. В молекуле т - РНК есть два активных участка - антикодон, который соединяется с кодоном и - РНК, и участок с триплетом ЦЦА, связывающимся с активирующим аминокислоты ферментом аминоацил-т - РНК-синтетазой. Эти ферменты специфичны по отношению к соответствующим аминокислотам. В активации аминокислот принимает также участие АТФ. Соединение антикодона т - РНК с кодоном и - РНК происходит только после образования комплекса аминокислота - фермент - т - РНК. Следовательно, из фонда клеточных аминокислот т - РНК выбирает соответствующую своему антикодону аминокислоту и занимает свое место на кодоне и - РНК. [30]
Страницы: 1 2 3